Softening waters by ion-exchange method
| Английский | |
| Примечание | от автора: В данном реферате есть перевод на русском языке |
| Загрузить архив: | |
| Файл: ref-21269.zip (44kb [zip], Скачиваний: 206) скачать |
THE MINISTRY OF HIGHERAND
SECONDARY SPECIAL EDUCATION OF THE
TASHKENT CHEMICOL-TECHNOLOGICAL INSTITUTE
« FOREIGN LANGUAGES » CHAIR

THEME: softening WATERS BY THE METHOD OF IONIC EXCHANGE
WRITTEN BY: PULATOV H.L.
CHEKED: MADMUSAEVA L.SH.
ВВЕДЕНИЕ
ЖЕСТКОСТЬ ВОДЫ
Накипь и отложения солей на бытовой технике (например, в чайниках), белые хлопья в воде, пленка на чае и т.д. - все это показатели жесткой воды. Использование такой воды для хозяйственных целей вызывает ряд неудобств. Например, увеличивается расход мыла при стирке, медленно развариваются мясо и овощи, уменьшается срок службы бытовой техники. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. Жесткость питьевой воды по действующим стандартам должна быть не выше 7 мг-экв/л, и лишь в особых случаях допускается до 10 мг-экв/л. Для производственных целей использование жесткой воды недопустимо.
Общая жесткость воды - это совокупность свойств, обусловленных содержанием в ней ионов кальция и магния. Если концентрация этих ионов велика, то воду называют жесткой, если мала - мягкой. При большом содержании ионов магния, вода горьковата на вкус и оказывает послабляющее действие на кишечник. Различают карбонатную и некарбонатную жесткость. Карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При кипячении гидрокарбонаты разрушаются с образованием осадков малорастворимых карбонатов CaCO3, т.о. жесткость уменьшается, поэтому карбонатную жесткость называют временной. Т.о., при кипячении ионы Mg2+ и Ca2+ осаждаются в виде карбонатов. Например: Жесткость, сохраняющаяся после кипячения воды, называется постоянной или некарбонатной. Она обусловлена растворенными в воде кальциевыми и магниевыми солями сильных кислот (сульфатами и хлоридами). Жесткую воду перед употреблением умягчают.
· Первыйспособ - реагентный. Т.е., добавление гашеной извести и соды Na2CO3 (известковый способ), добавление полифосфатов.
· Второй способ - применение катионитов, т.е., синтетических ионообменных смол (фильтрование).
Ионообменные смолы
Это вещества, способные к ионному обмену при контакте с растворами электролитов. Ионообменная очистка позволяет извлекать и утилизировать широкий спектр загрязняющих веществ: тяжелые металлы, хром, нитраты и нитриты, ПАВ, цианистые соединения, радиоактивные вещества, а также умягчает и обезжелезивает воду. При этом достигается высокая степень очистки (до уровня ПДК). Кроме того иониты используются для обессоливания воды в процессе водоподготовки. Неорганические и органические иониты могут быть природными (например: цеолиты, целлюлоза, торф, древесина) и синтетическими (силикагель, сульфазол и наиболее важные ионообменные смолы).По знаку заряда обменивающихся ионов все иониты делятся на катиониты, проявляющие кислотные свойства и аниониты, обладающие основными свойствами. В зависимости от степени диссоциации ионообменные смолы могут быть сильными и слабыми. В зависимости от рода ионов, которые связаны с активными группами ионита, различают следующие его форму: для катионитов - водородную форму (H - форма) и солевую форму, когда активные группы связаны с ионами металлов (например, Na - форму, NH4 - форму), для анионитов OH - форму, Cl - форму и др.Способность ионита к полному обмену характеризуется обменной емкостью, которая равна числу его активных групп, принимающих участие в обмене. Для количественной характеристики ионообменных свойств ионитов обычно определяют их динамическую и иногда полную (общую) обменную емкость (статическую).Основные требования к ионитам, используемым для очистки воды: высокая обменная емкость, высокая скорость ионного обмена, достаточная устойчивость по отношению к кислотам, щелочам, окислителям и восстановителям, нерастворимость в воде, органических растворителях и растворах электролитов и ограниченная набухаемость. В Водоподготовке в бытовых условиях часто используются сильнокислотные катиониты отечественных и импортных производителей преимущественно для умягчения и обезжелезивания воды. Пример: Состав катионита можно выразить формулой Na2R, где Na+ - весьма подвижный катион. Если пропускать жесткую воду через слои катионита, то ионы натрия обмениваются на ионы кальция и магния:
Ca 2+ + Na2R = 2Na + + CaR
Mg 2+ + Na2R = 2Na + + MgR
Таким образом ионы Ca2+ и Mg2+ переходят из раствора в катионит, а ионы Na+ - из катионита в раствор, и жесткость устраняется. После обеднения катионита ионами Na+ катиониты обычно регенерируют. Их выдерживают в растворе NaCl, где происходит обратное замещение - ионы Na+ переходят в катионит, а ионы Ca2+ и Mg2+ - в раствор:
CaR + 2Na + = Na2R + Ca 2+
MgR + 2Na + = Na2R + Mg 2+
После этого регенерированный катионит может быть использован для смягчения новых порций жесткой воды. Аналогично и для анионитов. На степень регенерации влияет тип ионита, состав насыщенного слоя, природа, концентрация и раствор регенерирующего вещества, температура, время контакта и расход реагентов. Восстановление обменной емкости при регенерации обычно составляет 60 - 100 %. В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
|
Катионы |
Анионы |
|
Кальций (Ca2+) |
Гидрокарбонат (HCO3-) |
|
Магний (Mg2+) |
Сульфат (SO42-) |
|
Стронций (Sr2+) |
Хлорид (Cl-) |
|
Железо (Fe2+) |
Нитрат (NO3-) |
|
Марганец (Mn2+) |
Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, "вклад" в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Виды жесткости
Общая жесткость. Определяется суммарной
концентрацией ионов кальция и магния. Представляет собой сумму карбонатной
(временной) и некарбонатной (постоянной) жесткости. Карбонатная жесткость.
Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3)
кальция и магния. Данный тип жесткости почти полностью устраняется при
кипячении воды и поэтому называется временной жесткостью. При нагреве воды
гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в
осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей
сильных кислот (серной, азотной, соляной) и при кипячении не устраняется
(постоянная жесткость).
Единицы измерения
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3).
Один моль на кубический метр соответствует
массовой концентрации эквивалентов ионов кальция (1/2 Ca2+) 20.04 г/м3 и ионов
магния (1/2Mg2+) 12.153 г/м3. Числовое значение жесткости, выраженное в молях
на кубический метр равно числовому значению жесткости, выраженному в
миллиграмм-эквивалентах на литр (или кубический дециметр), т.е.
1моль/м3=1ммоль/л=1мг-экв/л=1мг-экв/дм3.
Кроме этого в зарубежных странах широко используются такие единицы жесткости,
как немецкий градус (do, dH), французский градус (fo), американский градус, ppm
CaCO3.
|
Единицы жесткости воды |
||||
|
Моль/м3 (мг-экв/л) |
Немецкий градус, do |
Французский градус, fo |
Американский градус |
ppm мг/дм3 СаСО3 |
|
1.000 |
2.804 |
5.005 |
50.050 |
50.050 |
Соотношение этих единиц жесткости представлено
в следующей таблице:
Примечание:
Один немецкий градус соответствует 10 мг/дм3 СаО или 17.86 мг/дм3 СаСО3 в воде.
Один французский градус соответствует 10 мг/дм3 СаСО3 в воде.
Один американский градус соответствует 1 мг/дм3 СаСО3 в воде.
Происхождение жесткости
Ионы кальция (Ca2+) и магния (Mg2+), а также
других щелочноземельных металлов, обуславливающих жесткость, присутствуют во
всех минерализованных водах. Их источником являются природные залежи
известняков, гипса и доломитов. Ионы кальция и магния поступают в воду в
результате взаимодействия растворенного диоксида углерода с минералами и при
других процессах растворения и химического выветривания горных пород.
Источником этих ионов могут служить также микробиологические процессы,
протекающие в почвах на площади водосбора, в донных отложениях, а также сточные
воды различных предприятий.
Жесткость воды колеблется в широких пределах и существует множество типов
классификаций воды по степени ее жесткости.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость,
обусловленная ионами кальция (хотя в отдельных редких случаях магниевая
жесткость может достигать 50-60%). С увеличением степени минерализации воды
содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л.
Содержание же ионов магния (Mg2+) в высокоминерализованных водах может
достигать нескольких граммов, а в соленых озерах - десятков граммов на один
литр воды
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод
подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям,
достигая обычно наибольшего значения в конце зимы и наименьшего в период
половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и
океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3)
Влияние жесткости
С точки зрения применения воды для питьевых
нужд, ее приемлемость по степени жесткости может существенно варьироваться в
зависимости от местных условий. Порог вкуса для иона кальция лежит (в пересчете
на мг-эквивалент) в диапазоне 2-6 мг-экв/л, в зависимости от соответствующего
аниона, а порог вкуса для магния и того ниже. В некоторых случаях для
потребителей приемлема вода с жесткостью выше 10 мг-экв/л. Высокая жесткость
ухудшает органолептические свойства воды, придавая ей горьковатый вкус и
оказывая отрицательное действие на органы пищеварения.
Всемирная Организация Здравоохранения (ВОЗ) не предлагает какой-либо
рекомендуемой величины жесткости по показаниям влияния на здоровье. В
материалах ВОЗ говорится о том, что хотя ряд исследований и выявил
статистически обратную зависимость между жесткостью питьевой воды и
сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о
причинном характере этой связи. Аналогичным образом, однозначно не доказано,
что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в
организме человека
Вместе с тем, в зависимости от рН и щелочности, вода с жесткостью выше 4 мг-экв/л может вызвать в распределительной
системе отложение шлаков и накипи (карбоната кальция), особенно при нагревании.
Именно поэтому нормами Котлонадзора вводятся очень жесткие требования к
величине жесткости воды, используемой для питания котлов (0.05-0.1 мг-экв/л
Кроме того, при взаимодействии солей жесткости с моющими веществами (мыло,
стиральные порошки, шампуни) происходит образование "мыльных шлаков"
в виде пены. Это приводит не только к значительному перерасходу моющих средств.
Такая пена после высыхания остается в виде налета на сантехнике, белье, человеческой
коже, на волосах (неприятное чувство "жестких" волос хорошо известное
многим). Главным отрицательным воздействием этих шлаков на человека является
то, что они разрушают естественную жировую пленку, которой всегда покрыта
нормальная кожа и забивают ее поры. Признаком такого негативного воздействия
является характерный "скрип" чисто вымытой кожи или волос.
Оказывается, что вызывающее у некоторых раздражение чувство
"мылкости" после пользования мягкой водой является признаком того,
что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В
противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие
кремы и прочие хитрости для восстановления той защиты кожи, которой нас и так
природа. Вместе с тем, необходимо упомянуть и о другой стороне медали. Мягкая
вода с жесткостью менее 2 мг-экв/л имеет низкую буферную емкость (щелочность) и
может, в зависимости от уровня рН и ряда других факторов, оказывать повышенное
коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений
(особенно в теплотехнике) иногда приходится проводить специальную обработку
воды с целью достижения оптимального соотношения между жесткостью воды и ее
коррозионной активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Адсорбционные процессы, включающие в себя как процессы чисто включающий в себя физические, так и процессы, ведущие к образованию новых химических веществ весьма разнообразны. К ним относятся и процессы ионообменной хроматографии, протекающие между ионитом и растворами электролита.
Благодаря своей универсальность и гибкости эти процессы нашли широкое применение в аналитической химии, пищевой и гидрометаллургической промышленности, в теплоэнергетике, водоподготовке и во многих других областях науки и техники, и в настоящее время вытесняют из производственной практики другие методы сорбции[1-3]. Несмотря на большой ассортимент промышленных ионитов, большинство из них, особенно, поликонденсационного типа отличаются такими низкими показателями, как низкая скорость сорбции, малая устойчивость к термическим, химическим воздействиям и др. Это ограничивает возможности и сферы их применения [4,5].
Нами получен новый монофункциональный сульфокатионит на основе взаимодействия стирола с доступным и дешевым отходом сельскохозяйственной и хлопкоочистительной промышленности.
SHAPE * MERGEFORMAT
|
CH=CH2 |
|
O |
|
C |
|
O |
|
H |
|
+ |
|
O |
|
CH |
|
CH |
|
CH2 |
|
... |
|
... |
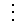
После сульфирования стирольно-фурфурольного полимера, полученный катионит переводили в Н-форму и определяли его основные физико-химические и сорбционные свойства. Для установления функциональности и степени их диссоциации была снята кривая потенциометрического титрования (рис.1), которую снимали методом отдельных навесок катионита в Н-форме, путем контактирования раствора хлористого натрия и едкого натрия (Сисх=0.1N раствор) по методике [8].
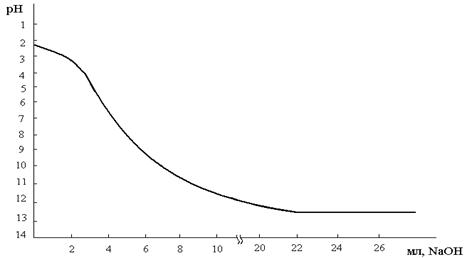
Рис.1. Кривая потенциометрического титрования.
По достижении равновесия через 48 часов определяли рН раствора на рН-метре «рН-340». Из рис.1 видно, что кривая потенциометрического титрования характеризует катионит как монофункциональный диссоциирующий в нейтральной, слабо- и сильнощелочной средах.
Кажущаяся константа диссоциации (рКн) ионогенных групп катионита, найденная из кривой титрования по методике [8] равна рКн=1.8–2.2. Значение рКн кажущейся константы диссоциации также свидетельствует, что полученный катионит относится к группе сильнокислотных ионитов.
Присутствие SO3H-групп в структуре полученного катионита подтверждают ИК-спектры поглощения сульфированного полимера. Так SO3H-группы в спектре сульфированного полимера характеризуются полосой поглощения в области 1200 см-1, что согласуется с литературными данными [9] Исследование сорбционной способности сульфокатионита к ионам кальция, магния, меди, никеля проводили из 0.1N растворов СаСl2, MgCl2, CuSO4 и NiSO4. Поглощение кальция и магния определяли трилонометрически, меди йодометрически, никеля фотоколориметри-чески [10,11]. Согласно литературным данным, полимеры и ионообменники, полученные на основе производных фурана отличаются повышенной термо-химостойкостью и механической прочностью [5,6]. Основные свойства полученного сульфокатионита представлены в таблице 1.
Как известно во многих регионах нашей республики используемая в быту и на производстве вода имеет высокую жесткость, которая иногда доходит до 12 мг-экв/л вместо получаемого в соответствии с ГОСТ 2874-82 «Питьевая вода» –2.5–7 мг-экв/л.
Таблица 1
Основные физико-химические показатели полученного сульфокатионита
|
№ |
Показатели |
Значения |
|
|
1. |
Насыпной вес, г/мл |
0.68 |
|
|
2. |
Удельный объем набухшего катионита в Н-форме, мл/г |
3.5 |
|
|
3. |
Статическая обменная емкость, в мг-экв/г, по: |
||
|
0.1N. раствору NaOH |
5,2 |
||
|
0.1N. раствору NaCl |
4.5 |
||
|
0.1N. раствору СaCl2 |
Н-форма |
4.2 |
|
|
Nа-форма |
4.8 |
||
|
0.1N. раствору MgCl2 |
Н-форма |
3.0 |
|
|
Nа-форма |
3.8 |
||
|
0.1 N. раствору СuSO4 |
Н-форма |
2.6 |
|
|
Nа-форма |
3.0 |
||
|
0.1 N. раствору NiSO4 |
Н-форма |
2.15 |
|
|
Nа-форма |
2.34 |
||
|
4. |
Механическая прочность |
99% |
Из данных таблицы 1 видно, что испытуемый катионит обладает достаточно высокими показателями величины обменной емкости по ионам кальция и магния.
В качестве объектаисследования нами была использована артезианская вода Шурчинского района Сурхандарьинской области, которая имеет жесткость 12.2 мг-экв/л. Катионитов испытывали вН- и Na-формах.
1 гр. катионита заливали 200 мл исследуемой воды. Через 24 часа воду отделяли от катионита и определяли ее жесткость трилонометрическим методом в присутствии индикатора хромоген черный. При этом жесткость воды в Н-форме составила 4.5 мг-экв/л, а в Na-форме 2.2 мг-экв/л.
Кроме этого нами были проведены исследования по умягчению водопроводной воды имеющий жесткость 2.5 мг-экв/л. После контакта в течение 6 часов водопроводной воды с катионитом жесткость ее соответствовала при использовании катионита в:
Н-форме – 0.8 мг-экв/л;
Na-форме – 0.4 мг-экв/л.
Результаты полученных исследований свидетельствует о перспективности работы с испытуемым сульфокатионитом.
INTRODUCTION
RIGIDITY of WATER
Scumand adjournment of salts on home appliances (for example, in teapots), film on tea etc. - all this parameters of rigid water. Use of such water for the economic purposes causes a number of inconveniences. For example, the charge of a soap is increased at washing, slowly boil soft meat and vegetables, service life of home appliances decreases. Interrelation of rigidity of water and education of stones in kidneys now is known.
The rigidity of drinking water under the working standards should be not higher 7 mg-ecv/g, and only in the special cases it is supposed up to 10 mg-ecv/g. For the industrial purposes use of rigid water is inadmissible.
The general rigidity of water is a set of properties caused by the contents in it ions of magnesium and calcium.
Hard water must be soften beforeuse.
The first way – reagent method i.e., addition slaked to exhaust and soda Na2CO3 (a limy way), addition of polyphosphates.
The second way - application of cationits , i.e., synthetic ion-exchange pitches (filtering).
Ion-exchangepitches
These are substances capable to an ionic exchange at contact to solutions of electrolits. Ionic-exchangeclearing allows to take and utilize a wide spectrum of polluting substances: heavy metals, chrom, nitrates and nitrites, cyanic connections, radioactive substances, and also умягчаетand unironingwater. Thus the high degree of clearing (up to a level of maximum concentration limit) is reached. Except for that ionits are used for unsaltingwaters during water-preparation. Inorganic and organic ionits can be natural (for example: zeolites, cellulose, peat, wood) and synthetic (silica geland the most important ion-exchange pitches). Depending on a degree dissociation of ion-exchangepitches can be strong and weak. Depending on a sort of ions which are connected to active groups of ionits, distinguish the following its form: for cationits- the hydrogen form (H-form) and the salt form, when active groups are connected to ions of metals (for example, Na-form, NH4-form), for anionits OH-form, Cl-form, etc. Ability of ionitsto a full exchange is characterized by exchange capacity which is equal to number of its active groups participating in an exchange. For the quantitative characteristic of ion-exchange properties of ionitsusually define their dynamic and sometimes full (general) exchange capacity (static). Main requirements to ionits, used for water treating: high exchange capacity, high speed of an ionic exchange, sufficient stability in relation to acids, alkalis, oxidizers and reducers, insolubility in water, organic solvents and solutions of electrolits and limited swelling capacity. In water-preparation in a conditions of life are frequently used high-acid cationitsdomestic and import manufacturers mainly for softeningand iron removal of waters. An example: the structure of cationitscan be expressed formula Na2R, where Na+ - rather mobile cation. If to pass hard water through layers of cationitsions of sodium exchange on ions of calcium and magnesium:
Ca2 + + Na2R = 2Na+ + CaR
Mg2 + + Na2R = 2Na+ + MgR
Thus ions Ca2+ and Mg2+ pass from a solution to cationit, and ions Na+-from cationitin a solution, and rigidity is eliminated. After pauperization of cationit ions of Na+ cationits usually recycle. Them maintain in solution NaCl where there is a return replacement - ions Na+ pass in cationit, and ions Ca2+ and Mg2+ - in a solution:
CaR + 2Na+ = Na2R + Ca 2+
MgR + 2Na + = Na2R + Mg 2+
After that regenerated cationitcan be used for mitigation of new portions of hard water. The degree of regeneration is influenced with type of ionits, structure of the sated layer, the nature, concentration and a solution of recycling substance, temperature, time of contact and the charge of reagents. Restoration of exchange capacity at regeneration usually makes 60 - 100 %.
Kinds of rigidity
General rigidity. It is defined by total concentration of ions of calcium and magnesium. Represents the sum of carbonate(time) and uncarbonate(constant) rigidity.
Carbonate rigidity. It is caused by
presence in water of hydrocarbonates and carbonates (at рН> 8.3) calcium and magnesium. The given type of rigidity almost
completely is eliminated at boilingwaters and consequently refers to as time rigidity. At heating water
hydrocarbonates break up with formation of a coal acid and settling out of a
carbonate of calcium and oxyhydroxide of magnesium.
Uncarbonate rigidity. It is caused by presence calcium and magnesian
salts of strong acids (the chamois, nitric, hydrochloric) and at boilingit is not eliminated (constant
rigidity).
Origin of rigidity
Ions of calcium (Ca2+) and magnesium (Mg2+), and also others alkali-ground metals causing rigidity, are present at all mineralizeed waters. Their source are natural deposits of limestones, plaster and dolomite. Ions of calcium and magnesium act in water as a result of interaction dissolved dioxide of carbon with minerals and at other processes of dissolution and chemical aeration of rocks. As a source of these ions, the microbiological processes proceeding in soil on the area of a reservoir can serve in ground adjournment, and also sewage of the various enterprises also.
Rigidity of water changes over a wide range and there is a set of types of classifications of water on a degree of its rigidity. Usually in little mineralizeed waters prevails (up to 70%-80 %) the rigidity caused by ions of calcium (though in separate rare cases magnesian rigidity can reach(achieve) 50-60 %). With increase in a degree of a mineralization of water the contents of ions of calcium (Са2+) quickly falls and seldom exceeds 1 g/l. The contents of ions of magnesium (Mg2+) in high mineralizeed waters can reach several grammes, and in salty lakes - tens grammes on one litre of water.As a whole, rigidity of superficial waters, as a rule, is less than rigidity of waters underground. Rigidity of superficial waters is subject to appreciable seasonal fluctuations, reaching usually the greatest value at the end of winter and the least during a high water when it is plentifully diluted soft rain and thawed snow. Sea and ocean water have very high rigidity (tens and hundreds inmg - ecv/l)
Influence of rigidity
From the point of view of application of water for drinking needs, its acceptability on a degree of rigidity can vary essentially depending on local conditions. The threshold of taste for an ion of calcium lays (in recalculation on a mg - equivalent) in a range of 2-6 mg - ecv/l, depending on corresponding of anionits, and a threshold of taste for magnesium and than that is lower. In some cases water is comprehensible to consumers with rigidity above 10 mg-ecv/l. High rigidity worsens organoleptic properties of water, giving to it bitterish taste and having negative an effect on bodies of digestion.
The world Organization of Public health services (CART) does not offer any recommended size of rigidity under indications of influence on health. In materials the CART is spoken that though a number of researches and has revealed statistically inverse relationship between rigidity of potable water and the cardiovascular diseases, the available data are not sufficient for a conclusion about causal character of this communication. Similarly, unequivocally it is not proved, that soft water renders a negative effect on balance of mineral substances of an organism of the person
At the same time, depending on рНand alkalinity, water with rigidity of 4 mg-ecv/l can above cause in distributive system adjournment of slags and scums (a carbonate of calcium), is especial at heating. For this reason norms of Boiler inspection enter very rigid requirements to size of rigidity of the water used for a meal of boilers (0.05-0.1 mg-ecv/l). Besides at interaction of salts of rigidity with washing substances (the soap, detergent powders, shampoos) occurs formation of "soap slags" as foam. It results not only in the significant overexpenditure of washing-up liquids. Such foam after drying remains as a strike on the sanitary technician, linen, a human skin, on hair (unpleasant feeling of "rigid" hair well-known to much). The main negative influence of these slags on the person is that they destroy a natural fatty film with which the normal skin is always covered and hammer its time. An attribute of such negative influence is characteristic "scratch" of cleanly washed up skin or hair. It appears, that the irritation causing in some people feeling "soapiness" after using soft water is an attribute of that the protective fatty film on a skin is whole and safe. It also slides.
At the same time, it is necessary to mention and other side of a medal. Soft water with rigidity less than 2 mg-ecv/l has low buffer capacity (alcalinity) and can, depending on a level рН and of some other factors, render the increasedcorrosive attack to water pipes. Therefore, in a number of applications (it is especial in the heating engineer) sometimes it is necessary to carry out special processing of water with the purpose of achievement of an optimum ratio between rigidity of water and its corrosion activity.
EXPERIMENTAL PART
The adsorption processes including both processes cleanly including physical, and the processes conducting to formation of new chemical substances are rather various. Processes concern to them ion-exchange chromatographies proceeding between ionits and solutions of electrolit also.
Due to the universality and these processes have found of flexibility wide application in analytical chemistry, food and an iron and steel industry, in power system, water-preparation and in many other areas of a science and technics(technical equipment), and now supersede from an industrial practice other methods sorption[1-3]. Despite of the big assortment industrial ionits, the majority of them, especially, condensation type differ such low parameters, as low speed sorption, small stability to thermal, chemical influences, etc. It limits opportunities and spheres of their application [4,5].
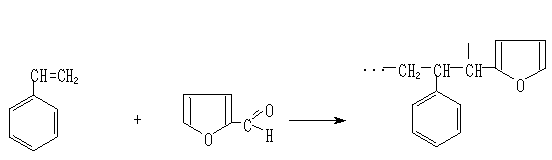
By us it is received new monofunctional sulphocationiteon the basis of interaction of styrene with an accessible and cheap waste of agricultural and cotton scraping industries.
SHAPE * MERGEFORMAT
|
CH=CH2 |
|
O |
|
C |
|
O |
|
H |
|
+ |
|
O |
|
CH |
|
CH |
|
CH2 |
|
... |
|
... |

Sorption abilities of sulphocationite to ions of calcium, magnesium, copper, nickel carried out research from 0.1N solutions of СаСl2, MgCl2, CuSO4 and NiSO4. Sorption of calcium and magnesium determined by trilonometric, copper by iodometric, nickel by photocolorimetric methods [10,11].
According to the literary data, polymers and ion-exchangers, received on the basis of derivatives of furan differ from raised thermal and chemical stability and mechanical durability [5,6]. The basic properties of received sulphocationiteare submitted in table 1.
Table 1
The main physical and chemical parameters of received sulphocationite
|
№ |
Parameters |
Values |
|
|
1. |
Bulk weight, g/ml |
0.68 |
|
|
2. |
Specific volume of bulk cationitin Н-form, ml/g |
3.5 |
|
|
3. |
Static exchange capacity, in mg - ecv/g, on: |
||
|
0.1N. solution of NaOH |
5,2 |
||
|
0.1N. solution of NaCl |
4.5 |
||
|
0.1N. solution of СaCl2 |
Н-form |
4.2 |
|
|
Nа-form |
4.8 |
||
|
0.1N. solution of MgCl2 |
Н-form |
3.0 |
|
|
Nа-form |
3.8 |
||
|
0.1 N. solution of СuSO4 |
Н-form |
2.6 |
|
|
Nа-form |
3.0 |
||
|
0.1 N. solution of NiSO4 |
Н-form |
2.15 |
|
|
Nа-form |
2.34 |
||
|
4. |
Mechanical durability |
99 % |
As is known in many regions of our republic used in a life and on manufacture water has high rigidity which sometimes reaches up to 12 mg-ecv/l instead of 2874-82 "Potable water" received according to GOST – 2.5-7 mg-ecv/l.
From the data of table 1 it is visible, that the examinee cationitpossesses high enough parameters of size of exchange capacity on ions of calcium and magnesium. As object of research we had been used artesian water of area Shurchi in Surkhan-Darya area which has rigidity of 12.2 mg-ecv/l. Cationitstested in Н-and Na-forms.
1 gr. of cationit filled in 200 ml of researched water. In 24 hours water separated from cationitand determined its rigidity trilonometric method at the presence of the indicator chromogen black. Thus rigidity of water in the Н-form has made 4.5 mg - ecv/l, and in the Na-form of 2.2 mg - ecv/l.
Except for it we had been carried out researches on softening water of 2.5 mg-ecv/l having rigidity. After contact within 6 hours of water with cationit rigidity of it corresponded at use cationit in:
the Н-form – 0.8 mg-ecv/l;
the Na-form – 0.4 mg-ecv/l.
Results of the received researches testifies to perspectivity of work with the examinee with sulphocationite.
Vocabulary
|
1. Adjournment 2. Artesian water 3. Cationit 4. Anionit 5. Sorption 6. Sulphocationite 7. Rigidity 8. Indicator chromogen black 9. Thrilonometric 10. Bulk weight 11. Condensation 12. Hydrocarbonate 13. Slag 14. Scum 15. Ionits 16. Alkalinity 17. Softening 18. Calcium 19. Magnesium. 20. Sewage 21. Corrosion activity 22. Static exchange capacity 23. Swelling capacity 24. Iodometric, 25. Photocolorimetric 26. Chemical stability 27. Thermal stability 28. Reagent method 29. Potable water 30. Cotton scraping industries 31. Polycondensation 32. Correspond 33. Сopper 34. desorption 35. Potentiometric titration 36. Flexibility 37. Specificvolume |
––– –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– |
Отложения Артезианская вода Катионит Анионит Сорбция Сульфокатионит Жесткость Индикатор хромоген черный Трилонометрический Насыпной вес Конденсация Гидрокарбонат Шлак Накипь Ионит Щелочность Умягчение Кальций Магний Сточные воды Деятельность коррозии Статическая обменная емкость Влажность Иодометрический Фотокалориметрический Химическая устойчивость Термическая устойчивость Реагентный метод Питьевая вода Хлопчатоочистительная пром. Поликонденсация Переписываются Медь Десорбция Потенциометрич. титрование Гибкость Удельный объем |
Литература
1.Полянский Н.Г. Сб. Синтез и свойства ионообменных материалов», М.: «Наука»,1968г.
2.Либинсон Г.С. Физико-химические свойства карбоксильных катионитов, М.: «Наука», 1969.
3.Гельферих Ф. «Иониты»,М.: Изд. ИЛ., 1962 г.
4.Таджиходжаев З.А. Разработка ионообменных и композиционных материалов многофункционального назначения на основе вторичных продуктов производств и технологии их получения».: Автореф. дисс. доктора технических наук. «, Ташкент.: 2002.
5.Муталов Ш.А., Турсунов Т., НазироваР.А. Исследование сорбции ионов цветных металлов слабоосновными анионитами поликонденсационного типа./Ж. Композиционные материалы. № 2, С.7-8. Ташкент:. 2003.
6.Таджиходжаев З.А., Джалилов А.Т. Синтез и исследование свойств катионообменных смол на основе вторичных продуктов химических предприятий.// Ж. Прикл. химии. 1998. т. 72. № 9. С. 1578-1580.
7.Гриссбах Р. «Теория и практика ионного обмена», М.: Изд. ИЛ. 1963., с. 303 – 310.
8.Л.Беллами «Инфракрасные спектры сложных молекул», М.: ИЛ, 1963г.
9.Алексеев В.Н. «Количественный анализ», М.: Химия, 1972г.
10. Пешкова В.М., Громова М.И. Практическое руководство по спектрофотометрии и калориметрии. М.: Изд.«Московского Университета», 1965 г.