Синтез хлорида олова (IV)
| Загрузить архив: | |
| Файл: ref-21839.zip (251kb [zip], Скачиваний: 66) скачать |
Содержание.
Литературный обзор……………………………………..………………..……….2
Экспериментальная часть…………………………………………...……………15
Выводы……………………………………………………………………………19
Список литературы……………………………………………………………….20
Введение.
В этой работе рассмотрены свойства хлорида олова (IV), методы синтеза и применение. Хлорид олова (IV) – вещество, необходимоев неорганическом синтезе; в данный момент влаборатории отсутствует. Таким образом, основной целью этой работы является синтез хлорида олова (IV).
Литературный обзор.
Тетрагалогениды.
Известны все четыре тетрагалогенида олова (табл. 1). Молекулы SnX4 представляют собой правильные тетраэдры с атомом Sn в центре. Все тетрагалогениды олова, кроме SnF4, не содержат мостиковых атомов галогена, благодаря чему эти соединения легкоплавки и легколетучи. В тетрафториде SnF4имеются октаэдрические фрагменты SnF6, образующие слои за счет мостиковой функции четырех (экваториальных) атомов фтора (олово(IV) имеет КЧ = 6). Естественно, что мостиковый характер SnF4 и больший ионный вклад в связь Sn—F по сравнению со связью Sn—X в других тетрагалогенидах приводит к существенно большей прочности кристаллической структуры SnF4 (температура возгонки 705 °С). [1]
Фторид SnF4 — бесцветное кристаллическое вещество, растворяется в воде с большим выделением тепла. С водными растворами фторидов образуются фторостаннаты (ЩЭ)2[SnF6].
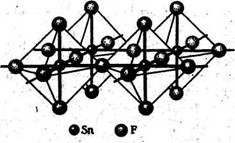
Рис. 1. Структура SnF4
Тетрахлорид SnCI4— бесцветная, дымящая на воздухе подвижная жидкость, растворяется в неполярных органических растворителях, с бензолом и сероуглеродом смешивается в любых отношениях. Тетрахлорид олова растворяет серу, фосфор, иод, тетраиодид олова. При растворении в воде SnCI4 подвергается гидролизу с образованием SnO2 • xH2O и гексахлорооловянной кислоты H2[SnCl6]:
3SnCl4 + 2H2O = SnO2 + 2H2[SnCl6].
Последнюю можно выделить из раствора в виде кристаллогидрата состава H2[SnCl6] • 6Н2О. Гексахлорооловянная кислота является сильной кислотой; растворы ее солей, благодаря отсутствию гидролиза, имеют нейтральную реакцию и не разрушаются даже при кипячении.
Из водного солянокислого раствора тетрахлорида олова можно выделить кристаллогидрат SnCl4• 5Н2О в виде белых легко расплывающихся кристаллов. Кристаллогидрат SnCl4 • 5Н2О, по-видимому, следует рассматривать как комплексное соединение H2[SnCl4(OH)2] • ЗН2О, устойчивое в присутствии НС1, которая подавляет гидролиз SnCl4. Известны также соли состава (ЩЭ)[SnCI5] с тригонально-бипирамидальным анионом.
Тетрабромид SnBr4— бесцветное кристаллическое вещество, растворимое в ацетоне и трихлориде фосфора РС13, в водном растворе гидролизуется, но из кислых растворов удалось выделить кристаллогидрат SnBr4*4H2O. Получены также гексабромооловянная кислота H2[SnBr6] и ее соли.
Тетраиодид SnI4— желтое кристаллическое вещество, легко растворяется в спирте, эфире, бензоле, сероуглероде; в водном растворе гидролизуется; иодостаннаты состава (ЩЭ)2[SnI6] получены только для рубидия и цезия.
Все SnX4, кроме SnF4, получают взаимодействием олова с избытком галогена:
Sn + 2Х2 = SnX4.
Тетрафторид синтезируют действием безводного фтороводорода на SnCl4.
Известны также смешанные тетрагалогениды олова, например, SnClBr3, SnCl3Br, SnBr2I2, которые по свойствам сходны с «однородными» галогенидами.
Таблица 1.Свойства тетрагалогенидов олова
|
SnX4 |
Tпл,оC |
Ткип, оС |
Цвет |
Энергия связи Sn – X, кДж/моль |
∆fHо298кДж/моль |
|
SnF4 |
- |
705(возг) |
Бесцветный |
414 |
- |
|
SnCl4 |
-36 |
114 |
Бесцветный |
323 |
-529 |
|
SnBr4 |
33 |
203 |
Бесцветный |
273 |
-406 |
|
SnI4 |
146 |
346 |
Жёлтый |
205 |
-215 |
Для олова получены и все четыре дигалогенида.
Дигалогениды.
Дихлорид SnCl2 – бесцветное кристаллическое вещество; легко растворяется в воде, спирте, эфире, ацетоне. Из водных растворов кристаллизуется в виде SnCl2 • 2Н2О («оловянная соль»). В водном растворе SnCl2 подвергается гидролизу, который протекает в существенно меньшей степени, чем в случае SnCl4, так как основные свойства у олова(П) выражены сильнее, чем у олова(IV):
SnCl2 + H2O = Sn(OH)Cl + HCl.
В растворе содержатся не только SnOH+, но и более сложные полимерные ионы, например [Sn3(OH)4]2+ и [Sn(OH)2Cl2]2-, которые могут взаимодействовать между собой.
Твердый SnCl2 также имеет полимерное строение. Его слоистая структура составлена из тригонально-пирамидальных групп [SnCl3], связанных друг с другом через атомы хлора:
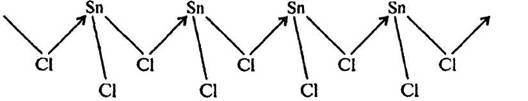
Рис. 2. Строение SnCl2.
В парах SnCl2 представляет собой угловую молекулу: угол ClSnCIсоставляет 95o. Несвязывающая электронная пара олова направлена к вершине треугольника. Характер связи (наложение ковалентной и ионной составляющих) Sn–Cl в SnCl2 и SnCl4 одинаков, но из-за цепочечного характера связей в твердом состоянии SnCl2 менее устойчив и легко диспропорционирует:
2SnCl2 = SnCl4 + Sn.
Дихлорид SnCl2 — сильный восстановитель. Он восстанавливаетиз растворов солей до металлов золото, серебро, ртуть, висмут, Fe3+ до Fe2+, хроматы до Сг3+ , перманганаты до Мn2+ , нитрогруппу до аминогруппы, бром до бромид-иона, сульфит-ион до серы, например:
2SnCl2 + H2SO3 + (2x + l)H2O = 2SnO2*xH2O + S + 4HCI
или
2SnCl2 + H2SO3 + 8НС1 = S + 2H2[SnCl6] + 3H2O,
SnCl2 + Br2 + (2 + x)H2O = 2HC1 + 2HBr + SnO2 • xH2O
или
3SnCl2 + 3Br2 + (2 + x)H2O = H2[SnCI6] + H2[SnBr6] + SnO2 • xН2О.
В водном растворе SnCI2 медленно окисляется кислородом воздуха. Чтобы препятствовать этому, в раствор добавляют металлическое олово. Остальные дигалогениды олова весьма сходны по свойствам с SnCl2.
Дигалогениды олова синтезируют нагреванием олова в токе галогеноводорода или осторожным обезвоживанием кристаллогидратов SnX2 • nН2О, полученных растворением олова в соответствующих галогеноводородных кислотах. Безводные SnX2 можно получить также непосредственным взаимодействием галогенов с избытком олова.
Все дигалогениды олова образуют комплексы (ЩЭ)[SnХз] и (ЩЭ)2lSnX4], но они менее устойчивы, чем производные олова(IV). Получают их в растворах соответствующих галогеноводородных кислот или их солей по реакции
SnX2 + 2NaX=Na2[SnX4].
В концентрированных растворах равновесие смешено вправо, при разбавлении смещается влево. Устойчивость галогенидных комплексов изменяется в следующем ряду: F > CI > Вг > I.
Многие галогениды олова, такие как SnCI4, SnCI2, а также продукты их гидролиза, например, Na2[Sn(OH)6], используют в качестве протрав при крашении тканей. Тетрахлорид SnCl4 применяют для приготовления дымовых завес и в качестве катализатора при хлорировании, а в органической химии — как стимулятор процесса конденсации. [3]
Таблица 2. Свойства дигалогенидов олова
|
SnX2 |
Tпл,оC |
Ткип, оС |
Цвет |
Отношение к воде |
∆fHо298 кДж/моль |
|
SnF2 |
210 |
— |
Бесцветный |
Растворим |
-648 |
|
SnCl2 |
247 |
623 |
Бесцветный |
Растворим |
-352 |
|
SnBr2 |
232 |
620 |
Бледно-желтый |
Растворим |
-254 |
|
Snl2 |
320 |
720 |
Оранжево-красный |
Нерастворим |
-152 |
II. Галогениды элементов подгруппы германия.
Молекулы тетраголагенидов ЭНаl4 имеют форму тетраэдра с атомом Э в центре. По мере увеличения размеров орбиталей в ряду GeHal4 - SnHal4 - PbHal4 устойчивость молекул заметно падает. Тетрабромид и тетраиодид свинца не известны.
В твердом состоянии тетрагалогениды, за исключением SnF4 и PbF4, имеют молекулярную решетку. Поэтому они легкоплавки и летучи. В обычных условиях GeF4 - газ, а ЭСl4 - жидкости, а ЭI4 - кристаллические вещества.
За исключением оранжевого GeI4 и желтых SnI4 и РbСl4, тетрагалогениды германия и его аналогов бесцветны.
Резкое возрастание температур плавления и кипения при переходе от GeF4 (т. пл. - 15 °С) к SnF4 (т. возг. 700 °С) и PbF4 (т. пл. ~ 600 °С) является следствием перехода от молекулярной решетки к полимерной. Кристаллы SnF4 и PbF4 имеют слоистую решетку, состоящую из октаэдрических структурных единиц. Таким образом, в PbF4 достигается устойчивое координационное число атома Рb - 6, и это соединение в отличие от других галогенидов свинца (IV) устойчиво.
Тетрагалогениды взаимодействуют также с основными галогенидами:
2KF + ЭF4 = K2[ЭF6]
Для Ge(IV), как и для Si(IV), характерны фторокомплексы [GeF6] 2-. Но получен и малостойкий Cs2[GeCl6]. Для Sn(IV) и Pb(IV) известны комплексные галогениды всех типов от M2[ЭF6] до М2[ЭI6]. Это свидетельствует о стабилизации у свинца степени окисления +4 в анионных комплексах с координационным числом 6. Галогенидные комплексы германия и олова устойчивы как в растворе, так и в кристаллических соединениях. Аналогичные соединения свинца легко гидролизуются. [2]
III. Методы синтеза.
На основании приведённых данных можно выделить следующие методы синтеза хлорида олова (IV):
Первый способ.
Удобный способ получения безводного SnCl4 основан на прямом синтезе:
Sn + 2Cl2 = SnCl4
Большую пробирку (длина 20—25 см, диаметр 3—4 см) заполняют на 3/4 гранулированным оловом. Пробирку закрывают пробкой с двумя отверстиями: в одно вставляют газоподводящую трубку, а другое — форштосс обратного холодильника (рис.3).
|
|
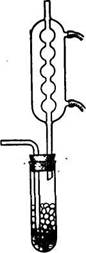
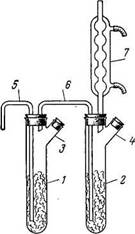
Рис. 3. Прибор для получения хлорного олова
Рис. 4. «Сдвоенный» прибор для получения хлорного олова:
1,2—
пробирки; 3,4—
тубусы; 5 — хлорподводящая трубка;
6 — соединительная трубка; 7—шариковый холодильник.
В пробирку наливают несколько миллилитров готового SnCl4 и пропускают (под тягой) сухой хлор с такой скоростью, чтобы газ успевал прореагировать с оловом. Реакция протекает бурно, иногда с появлением пламени. Когда на дне пробирки соберется значительный слой SnCl4, газоподводящую трубку несколько поднимают, но конец ее должен быть погружен в жидкость. По окончании реакции SnCl4 сливают в склянку, вносят несколько гранул Sn для связывания свободного хлора и выдерживают 1 ч в закрытой склянке. Затем жидкость перегоняют, собирая фракцию, кипящую при 112—114 oС (приемник для предохранения от влаги воздуха снабжают хлоркальциевой трубкой). Если исходное олово содержало Fe, то перегонку SnCl4 не следует доводить до конца (во избежание перехода примеси FeCl3). Полученный препарат переливают в склянку со стеклянной или корковой (но не резиновой!) пробкой.
Для приготовления большого количества SnCl4 (до 3 кг в день) рекомендуется прибор, изображенный на рис. 4. Две пробирки 1 и 2 (длина 20—25 см, диаметр 4 см) с тубусами 3 и 4 соединяют трубкой 6. К пробирке 2 присоединяют обратный холодильник 7. Пробирки заполняют на 3/4 гранулированным оловом и по трубке 5 пропускают ток сухого хлора, сначала медленно, во избежание сильного разогревания, затем, когда трубка 5 окажется погруженной в SnCl4, быстрее.
Когда пробирка 1 почти
заполнится SnCl4
(пробирка 2 к этому времени
наполняется приблизительно до половины) ток хлора прекращают, под
трубку 5 подставляют сухую склянку и через верхнее отверстие
холодильника 7 с помощью резиновой груши в прибор подают
струю воздуха. При этом SnCl4 почти
полностью переливается в подставленную склянку. Затем пробирки снова заполняют
через тубусы оловом и продолжают хлорирование. Для очистки препарат перегоняют,
добавив немного листового олова для связывания растворённого хлора. Собирают
фракцию, кипящую при 112-114 оС.
Выход 90-95%. [5]
Второй способ.
Собирают прибор согласно схеме (рис. 4.22).
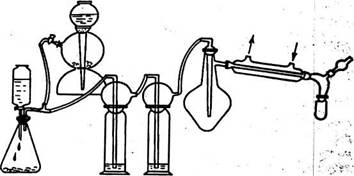
Рис. 5. Прибор для получение хлорида олова (IV).
Все части прибора должны быть тщательно высушены . В реакционную колбу помещают определенное количество металлического олова, заполняют прибор углекислым газом, колбу нагревают до плавления олова и пропускают в нее ток сухого очищенного хлора. Дальнейшее нагревание продолжают в том случае, если реакция замедляется.
Sn + 2Cl2 = SnCl4
По окончании реакции из системы вытесняют хлор сухим углекислым газом. Выход продукта оценивают по объему и плотности полученного вещества. Часть хлорида олова (IV) отгоняют в пробирку с оттянутым концом, которую затем запаивают, или в пробирку которую закрывают пробкой и парафинируют. Оставшуюся часть продукта используют для изучения его свойств.
Третий способ.
Безводный препарат можно получить также хлорированием безводного SnCl2
SnCl2 + Cl2 = SnCl4
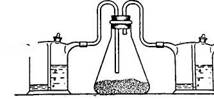
Рис. 6. Прибордля получения хлорного олова из SnCl2
В коническую колбу (рис. 5) помещают 200 г безводного SnCl2 и пропускают (под тягой) струю хлора со скоростью 60—70 пузырьков в минуту. Хлор предварительно пропускают через склянку Тищенко с конц. H2SO4. Избыток хлора поглощается в другой склянке Тищенко с раствором NaOH. Реакция протекает с сильным разогреванием реакционной смеси (до 70—80 оС) и вскоре кристаллическая масса SnCl2 превращается в жидкость (SnCl4). Конец реакции определяется по постепенному снижению температуры. Полученную жидкость переливают в колбу для перегонки, добавляют немного листового олова для связывания растворенного хлора и медленно перегоняют, собирая фракцию, кипящую при 112—114 оС.
Выход 250 г (90%).
На основании анализа литературных данных и исходя из наших возможностей, для получения тетрахлорида олова использовали метод, основанный на непосредственном взаимодействии олова с хлором (второй способ).
Экспериментальная часть.
1. Синтез тетрахлорида олова.
|
Вещество |
Молярная масса, М г/моль |
Масса m, г |
Кол-во вещества, ν моль |
Физические константы |
||
|
mтеор |
mпракт |
νтеор |
νпракт |
|||
|
Олово |
119 |
38,84 |
38,84 |
0,326 |
0,326 |
|
|
Оксид марганца (IV) |
87 |
56,72 |
150 |
0,652 |
1,72 |
|
|
Соляная кислота |
36,5 |
95,19 |
473,2 |
2,61 |
ω = 36,5% ρ = 1,183г/мл |
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
Sn + 2Cl2 = SnCl4
Собрать прибор (рис. 6) и тщательно высушить его.
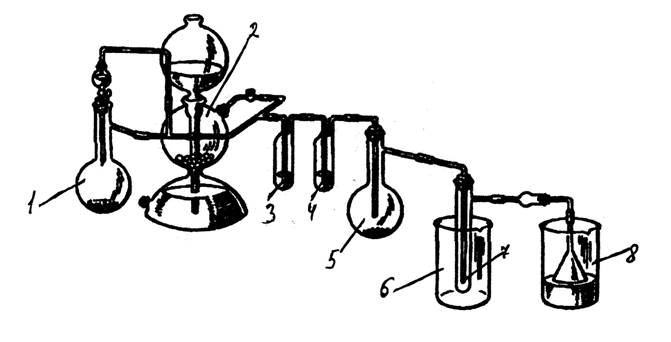
Рис 6. Прибор для получения хлорида олова (IV).
В колбу Вюрца емкостью 500 мл (1) засыпали оксид марганца (IV), в капельную воронку залили концентрированную соляную кислоту. В аппарат Киппа (2) засыпали мрамор (карбонат кальция), залили соляную кислоту. В реакционную колбу на 25 мл (5) засыпали металлическое олово. В промывалку (3) налили дистиллированную воду, в промывалку (4) – 96%-ю серную кислоту. В химический стакан (6) засыпали лёд. Хлоркальциевую трубку заполнили хлоридом кальция, воронку опустили в стакан со щёлочью (8).
Открыв кран на аппарате Киппа, продували прибор углекислым газом около 15 мин:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Прекратив подачу CO2, открыли капельную воронку, начали нагревать колбу (1):
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
Когда колба (5) заполнится хлором, начали нагревать её.
Sn + 2Cl2 = SnCl4
Олово начало гореть жёлто-белым пламенем. Нагрев возобновляли только в случае замедления реакции. По окончании реакции пробирка (7) заполнилась жёлтой жидкостью – хлоридом олова (IV).
Выход:
m(SnCl4)практ = 18,49 г
ν(SnCl4)теор= ν(Sn) = 0,326 моль
m(SnCl4)теор = ν(SnCl4)*M(SnCl4) = 0,326*261 = 85,09 г
ω = 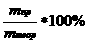 =
= 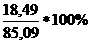 =
= 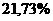
2. Идентификация тетрахлорида олова.
1) К полученному веществу прилили несколько капель водного раствора аммиака. Выпал белый осадок (α-оловянная кислота):
SnCl4 + 4NH4OH = H2SnO3↓ + 4NH4Cl + H2O
Этот осадок легко растворяется как в кислоте, так и в щёлочи:
H2SnO3 + 4HCl = SnCl4 + H2O
H2SnO3 + 2NaOH + H2O = Na2[Sn(OH)6]
2) К 2-3 каплям полученного вещества добавили 1 каплю концентрированной соляной кислоты, железные опилки и нагрели до появления пузырьков. Затем к раствору прибавили 2 капли раствора нитрата ртути (II). Выпал белый осадок:
Fe + SnCl4 = FeCl2 + SnCl2
SnCl2 + 2Hg(NO3)2 = Hg2Cl2↓+ Sn(NO3)4
3) На предметное стекло нанесли 1 каплю раствора полученного вещества, внесли кристаллик хлорида цезия. Вокруг кристаллика появился белый осадок:
H2[SnCl6] + 2CsCl = Cs2[SnCl6]↓ + 2HCl
Таким образом, на основе проведённых реакций, а также на основе метода синтеза можно сказать, что мы получили хлорид олова (IV).
Выводы.
1) Была собрана и изучена литература по тетрахлориду олова.
2) Был проведён синтез тетрахлорида олова.
3) С помощью качественных реакций было идентифицировано полученное вещество.
Список литературы.
1. Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – 3-е изд., перераб. и доп. – М.: Высш. шк., 1998. – 743 с., ил.
2. Никольский, А.Б. и др. Химия.- Санкт-Петербург, 2001.- C. 326-328
3. Спицын В.И., Мартыненко Л.И. Неорганическая химия. Ч II: Учебник. – М.: Изд-во МГУ, 1994. – 624с: ил.
4. Фадеева, В.И. и др. Основы аналитической химии.- Москва, 2001.
5. Свиридов В.В. и др. Неорганический синтез: Учеб. пособие / В.В. Свиридов, Г.А. Попкович, Е.И. Василевская. – 2-е изд., испр. – Мн.: Унiверсiтэцкае, 2000. – 224 с.
6. Карякин Ю.В., Ангелов И.И. Чистые химические вещества. Изд. 4-е, пер. и доп. М., «Химия», 1974. 408 с., 66 рис.