Коррозия металлов
| Загрузить архив: | |
| Файл: ref-23271.zip (15kb [zip], Скачиваний: 137) скачать |
Реферат на тему:
Коррозия металлов.
Подготовил: ученик 9 "А" класса
Алещик Андрей
Гродно 2006
Введение
Коррозия стали,ицветных металлов принципиально отличается от коррозионных процессов в неметаллическихстроительныхматериалах. Большинство так называемых драгоценныхметаллов, особенно сталь, в большей степениподвержены коррозии, чем неметаллические материалы. Средняя скорость коррозии основных металлов в условиях средне европейскогоклимата представленав табл. 2.1. Из таблицы видно, что наибольшие потеринаблюдаются для обычных сталей.Приведённые данныеявляются усредненными. Загрязнение, воздуха, особенновблизихимических заводов,приводитк значительному ускорению процессов коррозии. Врезультате коррозиипроисходят необратимые изменения -уменьшение площади сечения иснижение прочности,а также частоизменение внешнеговида поверхности металла.
Химическая коррозия
Химическую коррозиюстали вызывают сухие газыи жидкости, неимеющиехарактера электролитов,например органические соединения или растворы неорганических веществ в органических растворителях, Химическая коррозия не сопровождается возникновением электрического тока. Она основана на реакции междуметаллом и агрессивным реагентом. Этот вид коррозии протекает в основном равномерно по всей поверхности металла. В связи с этим химическая коррозия менее опасна, чем электрохимическая.
Продукты коррозиимогутобразовывать наповерхностиметалла плотныйзащитный слой, затормаживающийеё дальнейшееразвитие, илиже пористый слой, не защищающий поверхность от разрушающего воздействиясреды.В этомслучаепроцесс коррозии продолжается до полногоразрушенияматериала или период временипока будетдействовать агрессивнаясреда. Наиболеечасто на практике встречаетсягазовая коррозия
стали, вызваннаявоздействиемО2 , SO2 , H2S, CI, НС1,
NO3, CO2, CO и H2.
Электрохимическая коррозия
Электрохимическая коррозия происходит привзаимодействииметаллов сжидкими электролитами,в основном растворамикислот,оснований и солей.Механизм процесса коррозиизависит от структуры металла,а так же от типа электролита. Сталь,как всякийметалл, имеет кристаллическоестроение, прикотороматомы располагаютсявсоответствующемпорядке, образуяхарактерную пространственную решетку. Кристаллыжелезаимеют строение, значительно отличающиесяот идеальнойсхемы, так как имеютсяпустоты, не занятыеатомамиметалла, трещины,включенияпримесей кгазов .
Металлы обладают хорошей электропроводностью,что обусловленоналичиемсвободных электронов, движениекоторыхсоздает электрическийток.Числу свободныхэлектронов соответствует эквивалентноечисло ион-атомов,т.е. атомов,утратившиходин илиболее электрон. Вслучае возникновениянаконцах металлическогостержня разностипотенциаловэлектроны движутсяотполюса свысшимпотенциалом к противоположному полюсу. Металлы, обладающиеэлектронной проводимостью, являются проводниками первогорода, а электролиты, которыеимеют ионную проводимость проводниками второго рода.
Каждый металл имеет так называемую термодинамическую устойчивость, те. способностьион-атомов переходить в раствор электролита.При погружении какого-либо металла в чистую воду определенное число положительных ионов отрывается отметалла и переходит враствор, оставляяна поверхностиметалла соответствующеечисло электронов. В результатеэтого металл,погруженный в воду, имея избытоксвободныхэлектронов, получаетотрицательный электрический заряд, а на границе раздела фаз образуется двойной электрический слой.
Положительные ионы(благодаря притяжениюзарядовс противоположнымзнаком) удерживаютсявблизи поверхностиметалла.Возникает полеэлектрических сил, которое притягиваетк металлуионы, находящиеся в растворе. Однаконакопление ионовметалла приводит к затормаживаниюего дальнейшегорастворения. Черезнекоторое времяприопределенном потенциале наступает подвижное равновесие.
Если металл погружается не в чистую воду, ав раствор, могут быть следующие случаи:
1. Энергиягидратациираствора недостаточна для нарушения связимеждуион-атомами иэлектронами, Приэтом на поверхности металлабудут накапливаться катионы из раствора,а поверхностьприобретает положительныйзаряд.На границе металл -раствор устанавливается равновесие,а процесскоррозии прекращается.
2. Возможен переход ион-атомовв раствор, так как энергия гидратации больше чем энергия связив металлах.При этом коррозионный процесспротекает беспрепятственно.
Металл, погруженныйвэлектролит, является единичным электродом.Однакоабсолютная величина разностипотенциаловповерхности металлаи соприкасающегося с ним слоя раствора (а, следовательно, и склонность металла, из котороговыполнен электрод,к коррозии) неподдаетсяизмерению. Поэтомуза электрод сусловнымнулевым потенциалом принимаетсяводородный электрод,относительнокоторого определяютсяпотенциалы всех металлов. Это так называемыенормальные потенциалы.Водородныйэлектрод состоит изпластины,покрытой платиновойчернью, погруженной в раствор НС1 и омываемой водородом.
Нормальный потенциал может быть положительным или отрицательным. Он определяется при составленииэлемента, одним электродом которого является водородный электрод,а другим - металл, погруженный в раствор соли этого металла при температуре25' С и нормальном давлении. Величина потенциала зависитнетолько от типа металла,но и от концентрации раствора,температуры и давления. Все металлы в соответствии сих нормальнымипотенциалами, определеннымипо отношениюк водородномуэлектроду, образуютопределенный ряд.Этот ряд позволяет определить разностьпотенциалов, котораявозникаетмежду двумя металлами,погруженными вабсолютночистую, дистиллированную воду.
По положению металлав ряду потенциалов можно сделать вывод о том, что,например, железопри Контакте смедьюбудет подвергатьсяускоренной коррозии. В присутствиижецинка коррозиибудетподвергаться не железо, а цинк. Электролитом в этихслучаях служить даже следы влаги.
Величинапотенциалов,возникающих на электроде, зависит не только от металла, из которого выполнен электрод, нов ещебольшей степениот процессов, имеющихместо на электроде.
Как можно видеть, в зависимости от типа и содержания, растворённых вводе солейизменению подвергаются нетолько нормальныепотенциалы, нодаже положение металла в ряду потенциалов.
Коррозия при действии вод, несодержащих кислород.
Коррозия стали в воде зависит от количества кислорода, имеющего доступ к поверхности металла.
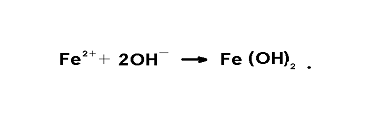
В воде, не содержащей кислорода,коррозия протекаетследующим образом:ион-атомы железа переходят в раствор, в результате чего на аноде происходитпотеря металла, аего поверхность приобретает отрицательный заряд: Fе, Fе2++2е. Электродыот анодадвижутся ккатоду, Вводе носителямитока являются водородные ионы Н+ и гидроокисные ионы ОН -, появляющиесяврезультате диссоциации воды.Ионы железа, которыеперешли враствор, соединяютсяс гидроокиснымианионами, образуяплохо растворимыйгидрат закиси железа:
Водородныекатионы соединяются сэлектронами, ина катодевыделяется атомарныйводород Н++е=Н. Он образует на поверхностиметалла защитныйслой, уменьшающийскорость коррозиистали (такназываемаяводородная деполяризация).
В некоторых случаях атомарный водород соединяется в молекулы газа Н+Н — Н2. Пузырьки водородарастут и отрываются от электрода, как только достигнут такой величины, чтобы преодолеть поверхностное натяжение.В этомслучаеэффект защитногослоя исчезает.
Если сталь соприкасается сраствором с рН>7, водород выделяется в атомарном виде, а следовательно, создаютсяусловия, способствующиеобразованиюзащитного слоя.Израстворов жесрН<7 водородвыделяетсяв виде газа.
Интенсивностьпроцесса коррозиин воде, не содержащейкислорода,зависит, такимобразом, от величиныpH.
Коррозия при действиивод, содержащихкислород.
В случае, когда стальсоприкасается сводой, содержащей кислород, коррозия происходит иначе.
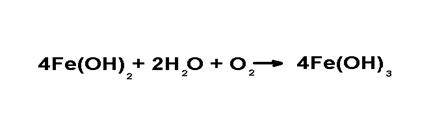
Содержащийся вводекислород связываетводород, образующий защитный слой на поверхности железа (кислородная деполяризация).А двухвалентноежелезо подвергается окислению в трехвалентное
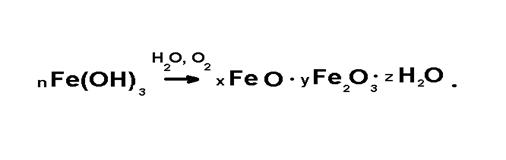
Гидроокись железавдальнейшем можетпереходить вгидратированные окиси (обычно называемые - пучиной)
Продукты коррозии не образуют плотноприлегающегок поверхностиметаллазащитного слоя. Это обусловлено, по-видимому, более чем двукратным увеличениемобъема, котороеимеет место припереходе гидроокисижелеза вгидратзакиси железа.
Наличие кислородавводе ускоряеткоррозиюстали, причем увеличение концентрации кислорода до определенногопредела приводитк резкомуувеличению коррозионной активности среды. При дальнейшем повышениисодержания кислорода скорость коррозии уменьшается в результате пассивации.