Металлы
| Загрузить архив: | |
| Файл: ref-26373.zip (488kb [zip], Скачиваний: 201) скачать |
Оглавление:
Строение атомов металлов (см. прил. №1).
Группы металлов.
II. Физические свойства металлов.
III. Понятие о сплавах.
IV. Химические свойства металлов.
V. Коррозия металлов.
VI. Способы получения металлов.
VII. Применение металлов.
VIII. Биологическая роль металлов.
IX. Список использованной литературы.
Строение атомов металлов (см. прил. №1).
Группы металлов.
В настоящее время известно 118 химических элементов, большинство из них - металлы. Последние весьма распространены в природе и встречаются в виде различных соединений в недрах земли, водах рек, озер, морей, океанов, составе тел животных, растений и даже в атмосфере.
В периодической системе Д.И.Менделеева каждый период, кроме первого (он включает в себя два элемента-неметалла – водород и гелий), начинается с активного химического элемента-металла. Эти начальные элементы образуют главную подгруппу I группы и называются щелочными металлами. Своё название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, - щелочей.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только один электрон, который они легко отдают при химических взаимодействиях, потому что являются сильнейшими восстановителями. Понятно, что в соответствии с ростом радиуса атома восстановительные свойства щелочных металлов усиливаются от лития к францию.
Следующие за щелочными металлами элементы, составляющие главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью (их атомы содержат на внешнем уровне два электрона). Из этих металлов кальций, стронций, барий и радий называют щелочноземельными металлами. Такое название эти металлы получили потому, что их оксиды, которые алхимики называли «землями», при растворении в воде образуют щелочи.
К металлам относятся элементы главной подгруппы III группы, исключая бор.
Из элементов главных подгрупп следующих групп к металлам относятся: в IV группе германий[1], олово, свинец (первые два элемента – углерод и кремний – неметаллы), в V группе сурьма и висмут (первые три элемента – неметаллы), в VI группе только последний элемент – полоний – явно выраженный металл. В главных подгруппах VII и VIII групп все элементы – типичные неметаллы.
Что касается элементов побочных подгрупп, то все они металлы.
Таким образом, условная граница между элементами-металлами и элементами-неметаллами проходят по диагонали B (бор) – Si (кремний) – As (мышьяк) – Te (теллур) – At (астат).
Атомы металлов имеют сравнительно большие размеры (радиусы), поэтому иих внешние электроны значительно удалены от ядра и слабо с ним связаны. И вторая особенность, которая присуща атомам наиболее активных металлов, - это наличие на внешнем энергетическом уровне 1 – 3 электронов.
Отсюда вытекает самое характерное свойство всех металлов – их восстановительная способность, т. е. способность атомов легко отдавать внешние электроны, превращаясь в положительные ионы. Металлы не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
II. Физические свойства металлов.
По своим свойствам металлы резко отличаются от неметаллов. Впервые это различие металлов и неметаллов определил М. В. Ломоносов. «Металлы, - писал он, - тела твердые, ковкие блестящие».
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду наличие у него определенного комплекса свойств:
1) Плотная кристаллическая структура.
2) Характерный металлический блеск.
3) Высокая теплопроводность и электрическая проводимость.
4) Уменьшение электрической проводимости с ростом температуры.
5) Низкие значения потенциала ионизации, т.е. способность легко отдавать электроны.
6) Ковкость и тягучесть.
7) Способность к образованию сплавов.
Все металлы и сплавы, применяемые в настоящее время в технике, можно разделить на две основные группы. К первой из них относят черные металлы - железо и все его сплавы, в которых оно составляет основную часть. Этими сплавами являются чугуны и стали. В технике часто используют так, называемые, легированные стали. К ним относятся, стали, содержащие хром, никель, вольфрам, молибден, ванадий, кобальт, титан и другие металлы. Иногда в легированные стали входят 5-6 различных металлов. Методом легирования получают, различные ценные стали, обладающие в одних случаях повышенной прочностью, в других - высокой сопротивляемостью к истиранию, в третьих - коррозионной устойчивостью, т.е. способностью не разрушаться под действием внешней среды.
Ко второй группе относят цветные металлы и их сплавы. Они получили такое название потому, что имеют различную окраску. Например, медь светло-красная; никель, олово, серебро – белые; свинец - голубовато-белый, золото - желтое. Из сплавов в практике нашли большое применение: бронза - сплав меди с оловом и другими металлами, латунь - сплав меди с цинком, баббит - сплав олова с сурьмой и медью и др.
Это деление на черные и цветные металлы условно.
Наряду с черными и цветными металлами выделяют еще группу благородных металлов: серебро, золото, платину, рутений и некоторые другие. Они названы так потому, что практически не окисляются на воздухе даже при повышенной температуре и не разрушаются при действии на них растворов кислот и щелочей.
C внешней стороны металлы, как известно, характеризуются, прежде всего, особым «металлическим» блеском, который обусловливается их способностью сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно только в том случае, когда металл образует сплошную компактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными, в порошок, но большинство металлов в мелкораздробленном виде имеет черный или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и электропроводностью, причем по способности проводить тепло и ток располагаются в одном и том же порядке: лучшие проводники - серебро и медь, худшие - свинец и ртуть. С повышением температуры электропроводность падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая механическая деформация. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры. Согласно современным воззрениям, кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отщепившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т.е. возникает электрический ток.
Наличием свободных электронов обусловливается и высокая теплопроводность металлов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них - следующим и т.д., и тепловое состояние металла быстро выравнивается; вся масса металла принимает одинаковую температуру.
По плотности металлы условно подразделяются на две большие группы: легкие металлы, плотность которых не больше 5 г/см3, и тяжелые металлы - все остальные. Плотность, а также температуры плавления некоторых металлов приведены в приложении №2.
Частицы металлов, находящихся в твердом и жидком состоянии, связаны особым типом химической связи - так называемой металлической связью. Она определяется одновременным наличием обычных ковалентных связей между нейтральными атомами и кулоновским притяжением между ионами и свободными электронами. Таким образом, металлическая связь является свойством не отдельных частиц, а их агрегатов.
Некоторые металлы кристаллизируются в двух или более кристаллических формах. Это свойство веществ – существовать в нескольких кристаллических модификациях – называют полиморфизмом. Полиморфизм для простых веществ известен под названием аллотропия.
Олово имеет две кристаллические модификации:
· α – устойчива ниже 13,2°С (ρ = 5,75 г/см3). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
· β – устойчива выше 13,2°С (ρ = 6,55 г/см3). Это белое олово.
Белое олово – серебристо-белый очень мягкий металл. При охлаждении ниже 13,2°С он рассыпается в серый порошок, так как при переходе из β в α значительно увеличивается его удельный объем. Это явление получило название оловянной чумы.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний, выделяются своей способностью намагничиваться и долго сохранять состояние намагниченности. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля – это парамагнетики. Металлы, выталкиваемые магнитным полем – диамагнетики (медь, серебро, золото, висмут).
III. Понятие о сплавах.
Характерной особенностью металлов является их способность образовывать друг с другом или с неметаллами сплавы. Чтобы получить сплав, смесь металлов обычно подвергают плавлению, а затем охлаждают с различной скоростью, которая определяется природой компонентов и изменением характера их взаимодействия в зависимости от температуры. Иногда сплавы получают спеканием тонких порошков металлов, не прибегая к плавлению (порошковая металлургия). Итак, сплавы - это продукты химического взаимодействия металлов.
Кристаллическая структура сплавов во многом подобна чистым металлам, которые, взаимодействуя друг с другом при плавлении и последующей кристаллизации, образуют:
а) химические соединения, называемые интерметаллидами;
б) твердые растворы;
в) механическую смесь кристаллов компонентов.
Тот или иной тип взаимодействия определяется соотношением энергии взаимодействия разнородных и однородных частиц системы, то есть соотношением энергий взаимодействия атомов в чистых металлах и сплавах.
Однако некоторые примеси ухудшают качество металлов и сплавов. Известно, например, что чугун (сплав железа и углерода) не обладает той прочностью и твердостью, которая характерна для сталей. Помимо углерода, на свойства стали, влияют добавки серы и фосфора, увеличивающие ее хрупкость.
Из цветных сплавов отметим бронзу, латунь, мельхиор и дюралюминий.
Бронза – сплав на основе меди с добавкой (до 20%) олова. Бронза хорошо отливается, поэтому используется в машиностроении, где из неё изготавливают подшипники, поршневые кольца, клапаны, арматуру и т. д. Используется также для художественного литья.
Латунь – также медный сплав, содержащий от 10 до 50% цинка. Применяется в моторостроении.
Мельхиор – сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используется для изготовления сравнительно недорогих столовых приборов и художественных изделий.
Дюралюминий (дюраль, дуралюмин) – сплав на основе алюминия, содержащий медь, магний, марганец и никель. Имеет хорошие механические свойства, применяется в самолётостроение и машиностроение.
Окружающие нас металлические предметы редко состоят из чистых металлов. Только алюминиевые кастрюли или медная проволка имеют чистоту около 99,9%. В большинстве же других случаев люди имеют дело со сплавами. Так, различные виды железа и стали, содержат наряду с металлическими добавками незначительные количества углерода, которые оказывают решающее влияние на механическое и термическое поведение сплавов. Все сплавы имеют специальную маркировку, т.к. сплавы с одним названием (например, латунь) могут иметь разные массовые доли других металлов.
Для изготовления сплавов применяют различные металлы. Самое большое значение среди всех сплавов имеют, стали различных составов. Простые конструкционные стали, состоят из железа относительно высокой чистоты с небольшими (0,07—0,5%) добавками углерода. Так, чугун, получаемый в доменной печи, содержит около 10% других металлов, из них примерно 3% составляет углерод, а остальные — кремний, марганец, сера и фосфор. А легированные стали, получают, добавляя к железу кремний, медь, марганец, никель, хром, вольфрам, ванадий и молибден.
Никель наряду с хромом является важнейшим компонентом многих сплавов. Он придает сталям высокую химическую стойкость и механическую прочность. Так, известная нержавеющая сталь содержит в среднем 18% хрома и 8% никеля. Для производства химической аппаратуры, сопел самолетов, космических ракет и спутников требуются сплавы, которые устойчивы при температурах выше 1000 °С, то есть не разрушаются кислородом и горючими газами и обладают при этом прочностью лучших сталей. Этим условиям удовлетворяют сплавы с высоким содержанием никеля. Большую группу составляют медно-никелевые сплавы.
Сплав меди, известный с древнейших времен, - бронза содержит 4-30% олова (обычно 8-10%). До наших дней сохранились изделия из бронзы мастеров Древнего Египта, Греции, Китая. Из бронзы отливали в средние века орудия и многие другие изделия. Знаменитые Царь-пушка и Царь-колокол в Московском Кремле также отлиты из сплава меди с оловом. В настоящее время в бронзах олово часто заменяют другими металлами, что приводит к изменению их свойств. Алюминиевые бронзы, которые содержат 5-10% алюминия, обладают повышенной прочностью. Из такой бронзы чеканят медные монеты. Очень прочные, твердые и упругие бериллиевые бронзы содержат примерно 2% бериллия. Пружины, изготовленные из бериллиевой бронзы, практически вечны. Широкое применение в народном хозяйстве нашли бронзы, изготовленные на основе других металлов: свинца, марганца, сурьмы, железа и кремния.
Сплав мельхиор содержит от 18 до 33% никеля (остальное медь). Температура плавления мельхиора составляет 1170 °С. Он имеет красивый внешний вид. Из мельхиора изготавливают посуду и украшения, чеканят монеты («серебро»). Похожий на мельхиор сплав - нейзильбер - содержит, кроме 15% никеля, до 20% цинка. Этот сплав используют для изготовления художественных изделий, медицинского инструмента. Медно-никелевые сплавы константан (40% никеля) и манганин (сплав меди, никеля и марганца) обладают очень высоким электрическим сопротивлением. Их используют в производстве электроизмерительных приборов. Характерная особенность всех медно-никелевых сплавов - их высокая стойкость к процессам коррозии - они почти не подвергаются разрушению даже в морской воде. Сплавы меди с цинком с содержанием цинка до 50% носят название латунь. Латунь "60" содержит, например, 60 весовых частей меди и 40 весовых частей цинка. Для литья цинка под давлением применяют сплав, содержащий около 94% цинка, 4% алюминия и 2% меди. Это дешевые сплавы, обладают хорошими механическими свойствами, легко обрабатываются. Латуни благодаря своим качествам нашли широкое применение в машиностроении, химической промышленности, в производстве бытовых товаров. Для придания латуням особых свойств в них часто добавляют алюминий, никель, кремний, марганец и другие металлы. Из латуней изготавливают трубы для радиаторов автомашин, трубопроводы, патронные гильзы, памятные медали, а также части технологических аппаратов для получения различных веществ.
По следующим рецептам можно получить легкоплавкие сплавы. Сплав Ньютона: 31 массовая часть свинца, 19 частей олова и 50 частей висмута. Температура плавления 95 °С. Сплав Вуда: 25 частей свинца, 12,5 частей олова, 50 частей висмута и 12,5 частей кадмия. Температура плавления 60 °С. Ложка из такого сплава расплавится, если ею помешать горячий кофе. Раньше это демонстрировали в качестве шутливого опыта. Однако перемешанный таким образом напиток ядовит из-за солей свинца и висмута!
Промышленные медно-никелевые сплавы условно можно разделить на две группы: конструкционные (или коррозионностойкие) и электротехнические (термоэлектродные сплавы и сплавы сопротивления).
К конструкционным сплавам относятся, куниаль, мельхиор, нейзильбер и др. Мельхиорами называют двойные и более сложные сплавы на основе меди, основным легирующим компонентом которых является никель. Для повышения коррозионной стойкости в морской воде их дополнительно легируют железом и марганцем. Нейзильберы по сравнению с мельхиорами характеризуются высокой прочностью из-за дополнительного легирования цинком. Куниалями называются сплавы тройной системы Cu-Ni-Al. Никель и алюминий при высоких температурах растворяются в меди в больших количествах, но с понижением температуры растворимость резко уменьшается. По этой причине сплавы системы Cu-Ni-Al эффективно упрочняются закалкой и старением. Сплавы под закалку нагревают до 900 -1000 оС, а затем подвергают старению при 500-600 оС. Упрочнение при старении обеспечивают дисперсные выделения фаз Ni3Al и NiAl. Мельхиор, нейзильбер, куниали отличаются высокими механическими и коррозионными свойствами, применяются для изготовления теплообменных аппаратов в морском судостроении (конденсаторные трубы и термостаты), медицинского инструмента, деталей точной механики и химической промышленности, деталей приборов в электротехнике, радиотехнике и для изготовления посуды. Мельхиор марки МН19 и нейзильбер марки МНЦ15-20 используются как резистивные сплавы.
К сплавам электротехническим относятся сплавы сопротивления - манганин (МНМц3-12) и константан (МНМц40-1б5) и сплавы для термоэлектродов и компенсационных проводов: копель (МНМц43-0,5).
Сплав Ньютона: 31 массовая часть свинца, 19 частей олова и 50 частей висмута. Температура плавления 95 °С.
Сплав Вуда: 25 частей свинца, 12,5 частей олова, 50 частей висмута и 12,5 частей кадмия (кадмий лучше всего получить в гальванической мастерской). Температура плавления 60 °С. Ложка из такого сплава расплавится, если ею помешать горячий кофе. Раньше это демонстрировали в качестве шутливого опыта. Перемешанный таким образом напиток ядовит из-за солей свинца и висмута!
В нашей маленькой печи мы можем получить немного латуни. Для этого расплавим медь с помощью бунзеновской или, лучше, стеклодувной горелки и затем добавим кусочки цинка; можно и сразу поместить кусочки обоих металлов в тигель. Латунь 60 содержит, например, 60 весовых частей мели и 40 весовых частей цинка (В СССР так называемые двойные латуни тоже маркируются по содержанию меди. Марка Л80, например, означает, что в латуни содержится 79-81 % меди, а остальное - цинк. - Прим. перев.).
Для литья цинка под давлением применяют сплав, содержащий около 94% цинка, 4% алюминия и 2% меди.
IV. Химические свойства металлов.
Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением:
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам двухвалентного свинца, тем самым, превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в виде металлического свинца. Если поступить наоборот, то есть погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено русским ученым Бекетовым, расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В приложении №3представлены значения стандартных электродных потенциалов некоторых металлов. Символом Me+/Me- обозначен металл Me, погруженный в раствор его соли. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак «-», а знаком «+» отмечены стандартные потенциалы электродов, являющихся окислителями.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, и образуют электрохимический ряд напряжений металлов:
LiRbKBaSrCaNaMgAlMnZnCrFeCdCoNiSnPbHSbBiCuHgAgPdPtAu
 |
Ряд напряжений характеризует химические свойства металлов:
1) Чем меньше электродный потенциал металла, тем больше его восстановительная способность.
2) Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений после него:
Fe0 + Cu+2SO4 = Fe+2SO4 + Cu0
Cu0 + Hg+2Cl2 = Hg0 + Cu+2Cl2
3) Все металлы, имеющие отрицательный стандартный электродный потенциал, то есть находящиеся в ряду напряжений левее водорода, способны вытеснять его из растворов кислот:
Zn0 + 2H+1Cl = Zn+2Cl2 + H20
А вот медь не реагирует с хлороводородной кислотой. Надо помнить, что это правило имеет ряд поправок:
а) правило соблюдается, если в реакции металла с кислотой образуетсярастворимая соль;
б) концентрированная серная кислота и азотная кислота любой концентрации реагирует с металлами по-особому, при этом водород не образуется;
в) на щелочные металлы правило не распространяется, так как они легко взаимодействуют с водой (а указанное правило относится к реакциям водных растворов кислот с металлами).
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре. Кроме того, нужно иметь в виду, что высокая электрохимическая активность металлов не всегда означает его высокую химическую активность. Например, ряд напряжений начинается литием, тогда как более активные в химическом отношении металлы: рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов.
С кислородом воздуха легко взаимодействуют щелочные и щелочноземельные металлы:
4Li0 + O20 = 2Li2+1O-2(4е-)
2Ca0 + O20 = 2Ca+2O-2(4е-)
С кислородом натрий и калий образуют не оксиды, а пероксиды:
2Na0 + O20 = Na2+1O2-1(2е-)
2K0 + O20 =
Железо, цинк, медь и другие, менее активные металлы энергично окисляются кислородом только при нагревании:
2Zn0 + O20 = 2Zn+2O-2(4е-)
2Cu0 + O20 = 2Cu+2O-2(4е-)
Золото и платиновые металлы не окисляются кислородом воздуха, ни при каких условиях.
На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов:
2Be0 + O20 = 2Be+2O-2(4е-)
2Mg0 + O20 = 2Mg+2O-2(4е-)
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в темных помещениях. В настоящее время используют электрическую вспышку.
Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов Ме, запишем в общей форме уравнение реакций щелочных металлов с неметаллами – водородом, хлором и серой:
 2Me0 + H20
= 2Me+1H-1(2е-)
2Me0 + H20
= 2Me+1H-1(2е-)
2Me0 + Cl20 = 2Me+1Cl-1(2е-)
2Me0 + S0 = Me2+1S-2(2е-)
Щелочноземельные металлы при высоких температурах окисляются водородом до гидридов:
Me0 + H20 = Me+2H2-1(2е-)
Бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании с неметаллами – хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды, нитриды:
Me0 + Cl20 = Me+2Cl2-1(2е-)
Me0 + S0 = Me+2S-2(2е-)
3Me0 + N20 = Me3+2N2-3(6е)
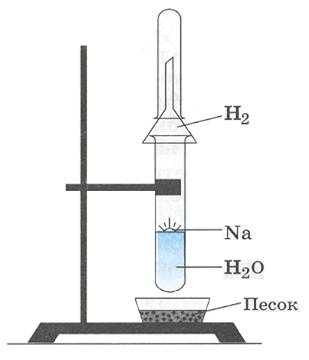
Все щелочные металлы активно взаимодействуют с водой, образуя щелочи ивосстанавливая воду до водорода (рисунок справа[2]). Скорость взаимодействия щелочного металла с водой будет увеличиваться от лития к цезию:
2Me0 + 2H+1OH = 2Me+1OH + + H20(2е-)
Из всех металлов главной подгруппы II группы только бериллий практически не взаимодействует с водой[3], магний реагирует с ней медленно, остальные металлы бурно взаимодействует с водой в обычных условиях:
Me0 + 2H+1OH = Me+2(OH)2 + H20(2е-)
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определённых условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную плёнку:
2Al0 + 6H2+10 = 2Al+3(OH)3 + 3H20
Железо взаимодействует с водой только в раскаленном виде:
3Fe0 + 4H2+1O = (Fe+2Fe2+3)O4 + 4H20
С кислотами в растворе (HCl, H2SO4(разб.), CH3COOH и др., кроме HNO3) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуется соль и водород.
2Al0 + 6H+1Cl = 2Al+3Cl3 + 3H20
2CH3COOH+1 + Mg0 = Mg+2(CH3COO)2 + H20
С солями менее активных металлов в растворе. В результате такой реакции образуется растворимая соль более активного металла и выделяется менее активный металл в свободном виде:
Fe0 + Cu+2SO4 = Fe+2SO4 + Cu0
V. Коррозия металлов.
Почти все металлы, приходя в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению. Причиной его является химическое взаимодействие металлов с находящимися в воздухе газами, а также водой и растворенными в ней веществами.
Всякий процесс химического разрушения металлов под действием окружающей среды называют коррозией.
Проще всего протекает коррозия при соприкосновении металлов с газами. На поверхности металла образуются соответствующие соединения: оксиды, сернистые соединения, основные соли угольной кислоты, которые нередко покрывают поверхность плотным слоем, защищающим металл от дальнейшего воздействия тех же газов.
Иначе обстоит дело при соприкосновении металла с жидкой средой - водой и растворенными в ней веществами. Образующиеся при этом соединения могут растворяться, благодаря чему коррозия распространяется дальше вглубь металла. Кроме того, вода, содержащая растворенные вещества, является проводником электрического тока, вследствие чего постоянно возникают электрохимические процессы, которые являются одним из главных факторов, обуславливающих и ускоряющих коррозию.
Чаще всего коррозии подвергаются изделия из железа. Особенно сильно коррозирует металл во влажном воздухе и воде. Упрощенно этот процесс можно выразить с помощью следующего уравнения химической реакции:
4Fe + ЗО2 + 6Н2O = 4Fe(ОН)3
Для борьбы с коррозией существует много способов. Назову некоторые из них.
1) Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешевые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.
 Предохраняемый металл
можно покрыть слоем другого металла: золота, серебра, хрома, никеля,
олова, цинка и др. Один из самых старых способов — это лужение, или покрытие
железного листа слоем олова. Такое железо называют белой жестью.
Предохраняемый металл
можно покрыть слоем другого металла: золота, серебра, хрома, никеля,
олова, цинка и др. Один из самых старых способов — это лужение, или покрытие
железного листа слоем олова. Такое железо называют белой жестью.
2) Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Легкие нержавеющие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса облицованный пластинками из титанового сплава (рисунок слева[4]). На его матовой блестящей поверхности нет ни одного пятнышка ржавчины.
3) Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называются ингибиторами коррозии.
Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже вспрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4) Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. Да и на суше металлическую конструкцию (трубу, ЛЭП и т. д.) соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде почти не ржавеет. Но обыкновенные технические металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
Убытки, причиняемые коррозией металлов, огромны. Вычислено, например, что вследствие коррозии, ежегодно гибнет, такое количество стали, которое равно приблизительно четверти всей мировой добычи его за год. Поэтому изучению процессов коррозии и отысканию наилучших средств ее предотвращения уделяется очень много внимания.
Способы борьбы с коррозией чрезвычайно разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия масляной краской, лаком, эмалью или, наконец, тонким слоем другого металла. Особый интерес с теоретической точки зрения представляет покрытие одного металла другим.
К ним относятся: катодное покрытие, когда защищающий металл стоит в ряду напряжений правее защищающего (типичным примером может служить луженая, то есть покрытая оловом, сталь); анодное покрытие, например покрытие, стали цинком.
Для защиты от коррозии целесообразно покрывать поверхность металла слоем более активного металла, чем слоем менее активного. Однако другие соображения нередко заставляют применять также покрытия из менее активных металлов.
На практике чаще всего приходится принимать меры, к защите стали как металла, особенно подверженного коррозии. Кроме цинка, из более активных металлов для этой цели иногда применяют кадмий, действующий подобно цинку. Из менее активных металлов для покрытия стали, чаще всего используют олово, медь, никель.
Покрытые никелем стальные изделия имеют красивый вид, чем объясняется широкое распространение никелирования. При повреждении слоя никеля коррозия проходит менее интенсивно, чем при повреждении слоя меди (или олова), так как разность потенциалов для пары никель-железо гораздо меньше, чем для пары медь - железо.
Из других способов борьбы с коррозией существует еще способ протекторов, заключающийся в том, что защищаемый металлический объект приводится в контакт с большой поверхностью более активного металла. Так, в паровые котлы вводят листы цинка, находящиеся в контакте со стенками котла и образующие с ними гальваническую пару.
VI. Способы получения металлов.
Огромное большинство металлов находится в природе в виде соединений с другими элементами.
Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь - отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой воды, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главными рудами являются оксиды, сульфиды и карбонаты металлов.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем.
Если, например, смешать красную медную руду (куприт) Cu2O с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превратится в оксид углерода(II), а медь выделится в расплавленном состоянии:
Cu2O + C = 2Cu + CO
Подобным же образом производится выплавка чугуна их железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов.
При переработке сернистых руд сначала переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные оксиды углем. Например:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C = Zn + CO
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и оксиды, так как при нагревании карбонаты распадаются на оксид металла и двуокись углерода. Например:
ZnCO3 = ZnO + CO2
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения - шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно «обогащают», то есть удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной смачиваемости чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и пустой силикатной породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого «коллектора», который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающиеся водой, оседают на дно. Пену собирают и отжимают, получая руду со значительно большим содержанием металла.
Для восстановления некоторых металлов из их оксидов применяют вместо угля водород, кремний, алюминий, магний и другие элементы.
Процесс восстановления металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии.
Очень важным способом получения металлов является также электролиз. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов.
Рассмотрим электролиз раствора сульфата меди(II) на нерастворимом аноде:
CuSO4 = Cu2+ + SO42-
Катод (–): Cu2+ + 2e- = Cu0 Анод (+): 2H2O – 4e- = O2 + 4H+
Cu2+ + 2e- = Cu0 2
2H2O – 4e- = O2 + 4H+ 1
Суммарное ионное уравнение: 2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Суммарное молекулярное уравнение с учетом присутствия анионов SO42- в растворе: 2CuSO4 + 2H2O =(электролиз)= 2Cu0 + O2 + 4H2SO4
VII. Применение металлов.
Среди свойств сплавов наиболее важными для практического применения являются жаропрочность, коррозионная стойкость, механическая прочность и др. Для авиации большое значение имеют легкие сплавы на основе магния, титана или алюминия, для металлообрабатывающей промышленности - специальные сплавы, содержащие вольфрам, кобальт, никель. В электронной технике применяют сплавы, основным компонентом которых является медь. Сверхмощные магниты удалось получить, используя продукты взаимодействия кобальта, самария и других редкоземельных элементов, а сверхпроводящие при низких температурах сплавы - на основе интерметаллидов, образуемых ниобием с оловом и др.
Современная техника использует огромное число сплавов, причем в подавляющем большинстве случаев они состоят не из двух, а из трех, четырех и большего числа металлов. Интересно, что свойства сплавов часто резко отличаются от свойств индивидуальных металлов, которыми они образованы. Так, сплав, содержащий 50% висмута, 25% свинца, 12,5% олова и 12,5% кадмия, плавится всего при 60,5 градусах Цельсия, в то время как компоненты сплава имеют соответственно температуры плавления 271, 327, 232 и 321 градус Цельсия. Твердость оловянной бронзы (90% меди и 10% олова) втрое больше, чем у чистой меди, а коэффициент линейного расширения сплавов железа и никеля в 10 раз меньше, чем у чистых компонентов.
Na2CO3 – карбонат натрия, образует кристаллогидратNa2CO3 * 10H2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Это средняя соль.
В быту более известна кислая соль – гидрокарбонат натрия NaHCO3, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода).
K2CO3 – карбонат калия, техническое название – поташ, и используется в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
Магний и кальций применяют для производства редких металлов и легких сплавов. Например, магний входит в состав дюралюминия, а кальций – одним из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочеккабелей.
В технике оксид кальция CaO называют негашеной известью, а MgO – жженой магнезией. Оба эти оксида используются в производстве строительных материалов.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:
4Al0 + 3O20 = 2Al2+3O3-2
Это реакция используется для изготовления бенгальских огней и фейерверков.
Алюминий широко используется в металлургии для получения металлов – хрома, марганца, ванадия, титана, циркония из их оксидов. Этот способ носит название алюминотермии. На практике часто применяется термит – смесь Fe3O4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
 Железо – это основа современной
техники и сельскохозяйственного машиностроения, транспорта и средств
связи, космических кораблей и вообще всей современной промышленности
и цивилизации. Большинство изделий, начиная от швейной иглы и кончая
космическими аппаратами, не может быть изготовлено без применения
железа.
Железо – это основа современной
техники и сельскохозяйственного машиностроения, транспорта и средств
связи, космических кораблей и вообще всей современной промышленности
и цивилизации. Большинство изделий, начиная от швейной иглы и кончая
космическими аппаратами, не может быть изготовлено без применения
железа.
 Сульфиды щелочноземельных
металлов, содержащие в малых количествах примесей тяжелых металлов,
после предварительного освещения начинают светиться различным
цветом – красным, оранжевым, голубым, зеленым. Они входят в состав
специальных светящихся красок, которые называют фосфорами. Их
используют для изготовления светящихся дорожных знаков, циферблатов и т.п.
Сульфиды щелочноземельных
металлов, содержащие в малых количествах примесей тяжелых металлов,
после предварительного освещения начинают светиться различным
цветом – красным, оранжевым, голубым, зеленым. Они входят в состав
специальных светящихся красок, которые называют фосфорами. Их
используют для изготовления светящихся дорожных знаков, циферблатов и т.п.
CaCO3 – карбонат кальция – одно из самых распространенных на Земле соединений. Нам широко известны такие содержащие его минералы, как мел, мрамор, известняк. Такжеего применяют для изготовления побелки.
Самый важный из этих минералов – известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомним знаменитые одесские катакомбы – бывшие каменоломни, в которыхдобывали камень для строительства города), во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и др.
Известняковой щебенкой укрепляют дороги, а порошком – уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных (рисунок на странице 15 (слева)[5]). Один из примеров использования мела мы хорошо знаем – это школьные мелки, зубные пасты. Мел используют в производстве бумаги, а также резины.
Мрамор – это минерал скульпторов, архитекторов и облицовщиков. Из мрамора создавал свои прекрасные творения Микеланджело (рисунок на странице 15(справа)[6]), стены всемирно- известного индийского мавзолея Тадж-Махал выложены из мрамора, мрамором облицованы многие станции московского метро.
MgCO3 – карбонат магния, широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т.е. не содержащей соединения металла, в шлак.
CaSO4 – сульфат кальция, встречается в природе в виде минерала гипса CaSO4 * 2H2O, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения неподвижныхгипсовых повязок, для получения слепков. Для этого применяют полуводный гипс 2CaSO4 * H2O – алебастр, который при взаимодействии с водой образует двуводный гипс:
2CaSO4 * H2O + H2O = 2CaSO4 * H2O
Эта реакция идет с выделением теплоты.
MgSO4 – сульфат магния, известный под названием горькаяили английская соль, используемый в медицине в качестве слабительно средства. Содержится в морской воде и придает ей горький вкус.
BaSO4 – сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике («баритовая каша») при заболеваниях желудочно-кишечного тракта.
Ca3(PO4)2 – фосфат кальция, входит в состав фосфоритов (горная порода) и апатитов (минералов), а также в состав костей и зубов в организме взрослого человека содержится более 1 кг. кальция в виде соединения Ca3(PO4)2.
Корунд – минерал состава Al2O3, обладает очень высокой твердостью, его мелкозернистая разновидность, содержащая примеси, - наждак, применяется как абразивный (шлифовочный) материал.
Хорошо известны прозрачные окрашенные примесями кристаллы корунда: красный – рубины и синие – сапфиры, которые используют как драгоценные камни. В настоящее время их получают искусственно и применяют не только для украшений, но и для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
FeS2 – не служит железной рудой для получения металлов, но применяется для производства серной кислоты.
Кристаллогидрат сульфата железа(II)FeSO * 7H2O, известны под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок и в других целях.
Хлорид железа(III) FeCl3 используют в качестве протравы при крашении тканей.
Сульфат железа(III)Fe2(SO4)3 * 9H2O применяется для очистки воды и в других целях.
Нитрат серебра AgNO3, называемый также ляписом. Образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике и в медицине.
VIII. Биологическая роль металлов.
Тяжелые металлы (, , , мышьяк, , , алюминий и др.) в микроколичествах необходимы организму и в основном они находятся в активных центрах коферментов (Л.Р. Ноздрюхина,1977, J.R.Glaister,1986).
При превышении допустимых концентраций они нарушают многие процессы в организме, начиная с клеточных мембран, т.к. многовалентные ионы металлов могут связываться со специфическими участками фосфолипидных полярных частей (В.А.Тутельян и др.,1987, F.W.Oehme,1978, L.J.Casaret et al.,1975). В результате этого взаимодействия происходит расширение или сжатие поверхности мембраны и, следовательно, изменение её обычных свойств (В.Калоус, З.Павличек,1985). Особенно опасны металлорганические соединения, т.к. они гораздо лучше проходят барьеры внутри организма. Некоторые металлы, например- , стронций, иттрий, замещают в организме кальций, а это приводит к хрупкости костей.
Количество биологически активных химических элементов в организмах животных и тканях в основном зависит от их места обитания и особенностей потребления кормов (С.Ф. Тютиков и др., 1997). В большинстве случаях сельскохозяйственные животные страдают от дефицита и несбалансированности микроэлементов (К.К.Заневский, 1992). При содержании тяжелых металлов в почве выше допустимых норм отмечают повышение поступления указанных металлов в рационы и соответственно в продукцию животноводства, ухудшение качества сельскохозяйственной продукции. Например, в пригородных хозяйствах при содержании в рационе тяжелых металлов- , никеля, и фтора в 2-7 раз выше ПДК содержание их в молоке оказалось в 1,25-2 раза выше допустимых (Н.И.Морозова, 1998). В Вологодской области из-за нехватки селена при избытке железа, марганца, отмечено поступление молока на молокозаводы с низкой титруемой кислотностью (В.И.Иванов,1995). Основной причиной являются выбросы предприятий Череповецкой промышленной зоны. Наличие тяжелых металлов влияет на качество сыра, при этом нарушается технология производства. В частности, ухудшается его вкус и запах становится нечистым, сыр легко крошится, творог становится мажущим (О.Ф.Сорокина и др., 1995). У овец, разводимых в промышленной зоне Ирака, отмечается депонирование в организме ртути, и (Аббас,1991). У пятилетних овец содержание ртути и в мускулатуре выше МДУ (максимально допустимого уровня). На ингаляционное поступление этих тяжелых металлов указывали повышенные содержания кадмия и в легких. Этот же автор указывает, что у овец, разводимых в сельскохозяйственных районах Ирака, содержание тяжелых металлов в тканях и органах оказались в 2-7 раз меньше, чем у животных, разводимых в промышленной зоне.
Авторы указывают, что поступление тяжелых металлов из почвы в растения возрастает параллельно с увлечением кислотности почвы. Это происходит потому, что их соединения лучше растворяются в кислой среде (Ge Y., Murray P., Hendershot W.H, 2000, Planquart P., Bonin G., Prone A., Massiani C., 1999). Доказано, что всасывание тяжелых металлов из тонкого отдела кишечника зависит от их растворимости в воде (C.A.Kan,1994). Известно, что длительное использование высоких доз азотных удобрений приводит к снижению микроэлементов в рационе (В.Т.Самохин и др., 1996). При техногенном загрязнении почвы тяжелыми металлами одновременно в ней возрастает доля их подвижных форм (В.А.Вострокнутов и др., 1998). Однако, с ростом доз азотных удобрений в почве отмечено небольшое увеличение концентрации , Mn, (А.А.Григорьев, В.В.Окороков, 1995). Почвенные микроорганизмы могут переводить нерастворимые формы солей в растворимые.
Таким образом, ещё многие и многие годы человечество будет использовать металлы, которые продолжают играть ведущую роль в развитии всехобластей его жизнедеятельности.
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионно-стойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000°С, в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.

IX. Список использованной литературы.
1.«Общая химия»; Н.Л. Глинка; издательство «Интеграл-Пресс»; 2018 год.
2.«Необычные свойства обычных металлов»; В.А. Займовский, Т.Л. Колупаева; библиотека «Квант»; 1997 год.
3.«Магниты
из сплавов редкоземельных металлов с кобальтом»;
перевод Р.С.
Торчиновой, Э.М. Лазарева; издательство
«Москва»;1995 год.
4.«Универсальный справочник по химии школьникам и абитуриентам»; А.А. Петров; издательство «Лист Нью»; 2003 год.
5.«Открой для себя мир химии. Часть 1»; Р.М. Голубева, Е.А. Алферова, Е.Ю. Раткевич, В. Шефер, П. Бенеш, Г.Н. Мансуров; издательство «Экомир»; Москва; 2004 год.
6.«Открой для себя мир химии. Часть 3»; Р.М. Голубева, Е.А. Алферова, Е.Ю. Раткевич, В. Шефер, П. Бенеш, Г.Н. Мансуров; издательство «Экомир»; Москва; 2004 год.
7.«Химия. 10 класс»; О.С. Габриелян; Ф. М. Маскаев; издательство «Дрофа»; Москва; 2005 год.
8.«Химия. 11 класс»; О.С. Габриелян; Г. Г. Лысова; издательство «Дрофа»; Москва; 2006 год.
9.«Настольная
книга для учителя по химии. 9 класс»;
О.С. Габриелян,
И.Г. Остроумов; издательство «Дрофа»;
Москва; 2005 год.
10. «Настольная книга для учителя по химии. 11 класс (часть II)»; О.С. Габриелян, Г.Г. Лысова; издательство «Дрофа»; Москва; 2006 год.
11. «Общая и неорганическая химия»; Н.С. Ахметов; издательство «Высшая школа»; Москва; 2005 год.
[1]Германий проявляет и некоторые неметаллические свойства, занимая промежуточное положение между металлами и неметаллами.
[2]Взаимодействие натрия с водой.
[3]Препятствует защитная плёнка на его поверхности.
[4]Обелиск «Покорителям космоса» (облицовка из титана).
[5]Мел под микроскопом.
[6]Скульптуры Микеланджело (мрамор): «Раб, рвущий путы» (справа), «Давид» (слева).