Железо
| Примечание | от редактора: автор не указала город и учебное заведение |
| Загрузить архив: | |
| Файл: ref-26923.zip (708kb [zip], Скачиваний: 295) скачать |
Железо.
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
Побочная подгруппа восьмой группы периодической системы охватывает три триады d-элементов. Первую триаду образуют элементы железо, кобальт и никель, вторую триаду — рутений, родий и палладий и третью триаду — осмий, иридий и платина.
Большинство элементов рассматриваемой подгруппы имеют два электрона в наружном электронном слое атома; все они представляют собой металлы. Кроме наружных электронов, в образовании химических связей принимают участие также электроны из предыдущего недостроенного слоя. Для этих элементов характерны степени окисленности, равные 2, 3, 4. Более высокие степени окисленности проявляются реже. В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Химический знак — Fе (феррум). Порядковый номер — 26, электронная формула 1s22s22p63s23p63d64s2. Электронно-графическая формула:
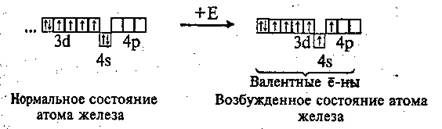
Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (Зd6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и иногда +6.
Сравнение физических и химических свойств элементов восьмой группы показывает, что железо, кобальт и никель, находящиеся в первом большом периоде, очень сходны между собой и в то же время сильно отличаются от элементов двух других триад. Поэтому их обычно выделяют в семейство железа. Остальные шесть элементов восьмой группы объединяются под общим названием платиновых металлов.
СЕМЕЙСТВО ЖЕЛЕЗА
. Железо (Ferrum). Нахождение в природе. Железо—самый распространенный после алюминия металл на земном шаре: оно
Таблица: Некоторые свойства железа, кобальта и никеля
|
Ре |
Со |
N1 |
|
|
Радиус атома, нм |
0,126 |
0,125 |
0,124 |
|
Энергия ионизации |
|||
|
Э → Э+, эВ |
7,89 |
7,87 |
7,63 |
|
Э+ → Э2+, эВ |
16,2 |
17,1 |
18,15 |
|
Э2+, → ЭЗ+, эВ |
30,6 |
33,5 |
35,16 |
|
Радиус иона Э2+, нм |
0,080 |
0,078 |
0,074 |
|
Радиус иона Э3+, нм |
0,067 |
0,064 |
|
|
Стандартная энтальпия ато- |
417,0 |
428,4 |
428,8 |
|
мизации металла при 25° С, |
|||
|
кДж на 1 моль атомов |
|||
|
Плотность, г/см3 |
7,87 |
8,84 |
8,91 |
|
Температура плавления, °С |
1539 |
1492 |
1455 |
|
Температура кипения, °С |
2870 |
3100 |
2900 |
|
Стандартный электродный по |
-0,440 |
-0,277 |
—0,250 |
|
тенциал процесса Э2 + |
|||
|
+2е=Э, В |
составляет 4% (масс.) земной коры. Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном состоянии железо находят только в метеоритах.
К важнейшим рудам железа относятся магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк 2Fe2O3•3H2Oи шпатовый железняк FeСОз. Встречающийся в больших количествах пирит, или железный колчедан, FeS2 редко применяется в металлургии, так как чугун из него получается очень низкого качества из-за большого содержания серы. Тем не менее железный колчедан имеет важнейшее применение — он служит исходным сырьем для получения серной кислоты
В пределах СССР месторождения железных руд находятся на Урале, где целые горы (например, Магнитная, Качканар, Высокая и др.) образованы магнитным железняком превосходного качества. Не менее богатые залежи находятся в Криворожском районе и на Керченском полуострове. Криворожские руды состоят из красного железняка, керченские — из бурого железняка. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири и на Дальнем Востоке. Общее количество железных руд в СССР составляет больше половины мировых запасов.
Значение железа и его сплавов в технике. Развитие металлургии. Из всех добываемых металлов железо имеет наибольшее значение. Вся современная техника связана с применением железа и его сплавов. Насколько важную роль играет железо, видно уже из того, что количество добываемого железа примерно в 15 раз превосходит добычу всех остальных металлов вместе взятых.
До XIX века из сплавов железа были известны в основном его сплавы с углеродом, получившие названия стали и чугуна. Однако в дальнейшем были созданы новые сплавы на основе железа, содержащие хром, никель и другие элементы. В настоящее время сплавы железа подразделяют на углеродистые стали, чугуны, легированные стали и стали с особыми свойствами
В технике сплавы железа принято называть черными металлами, а их производство — черной металлургией.
Добыча железа особенно быстро росла в прошлом столетии. В начале XIX века мировая выплавка чугуна равнялась всего 0,8 млн. т в год, а к концу она составила уже 66 млн. т в год. 'В 1962 г. в капиталистических странах было выплавлено 176 млн. т чугуна и ферросплавов и 245 млн. т стали.
По выплавке черных металлов царская Россия сильно отставала от промышленно развитых стран. Русская металлургическая промышленность выпустила в 1913 г. всего 4,2 млн. т чугуна и столько же стали. После первой мировой войны производство чугуна резко упало и составляло в 1920 г. всего 2,7% от выпуска 1913 г. Восстановление черной металлургии, осуществлявшееся в исключительно тяжелых условиях, потребовало огромных усилий и продолжительного времени; только в 1929 г. выплавка стали достигла уровня 1913г. . -
Быстрое развитие советской металлургии началось в годы первых пятилеток. Была полностью реконструирована металлургическая промышленность на юге европейской части СССР и создана новая угольно-металлургическая база в восточных районах нашей страны. Были построены крупнейшие металлургические заводы — Магнитогорский, Кузнецкий и др. Уже к концу первой пятилетки выплавка чугуна достигла 147% по сравнению с уровнем 1913 г. Восстановив дореволюционный уровень выплавки чугуна в 1929г., советские металлурги в следующие восемь лет увеличили выпуск чугуна почти в 3,5 раза. Для такого прироста металлургии США потребовалось в свое время 20 лет, Германии — 23 года.
Значительно выросла за последние годы и рудная база металлургии — осваивались новые железорудные месторождения в Казахстане, Сибири и в районе Курской магнитной аномалии. Добыча железной руды в 1977 г. достигла 240 млн. т.
Физические свойства железа.
В виде простого вещества Fе — серебристо-белый металл. В соответствии с усилением вклада ковалентной связи (за счет 3d-, 4d- и 6d-электронов соответственно) в ряду Fе—Ru—Оs теплота сублимации, температуры плавления и кипения заметно возрастают.
|
|
|
α-Fe β- Fe |
|
γ- Fe |
|
δ- Fe |
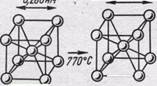
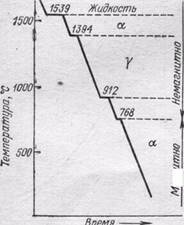
Рис. 235. Полиморфное превращение железа
Железо имеет четыре модификации (рис. 235). До 770°С устойчиво α-Fе с объемноцентрированной кубической решеткой и ферромагнитными свойствами. При 770°С α-Fе переходит в β-Fе; у него исчезают ферромагнитные свойства и железо становится .парамагнитным, но кристаллическая структура его существенно не изменяется. При 912°С происходит полиморфное превращение, при котором изменяется структура кристалла: из объемноцентрированной переходит в гранецентрированную кубическую структуру γ-Fе, а металл остается парамагнитным. При 1394°С происходит новый полиморфный переход и образуется δ-Fе с объемноцентрированной кубической решеткой, которое существует вплоть до температуры плавления железа (1539°С).
Диаграмма состояния системы железо — углерод. В 30-х годах XIX века русский инженер П. П. Аносов впервые применил микроскоп для изучения структуры стали и ее изменения после ковки и термической обработки. В 60-х годах XIX века подобные исследования стали проводиться и за границей.
|
|
В 1868 г. Д. К. Чернов впервые указал на существование определенных температур («критических точек»), зависящих от содержания углерода в стали и характеризующих превращения одной микроструктуры стали в другую. Этим было положено начало изучению диаграммы состояния Fе—С, а 1868 г. стал годом возникновения металловедения — науки о строении и свойствах металлов и сплавов. Французский исследователь Ф. Осмонд стал пользоваться только что изобретенным Ле Шателье пирометром и уточнил значения «критических точек». Он описал характер микроструктурных изменений, наблюдаемых при переходе через эти точки, и дал названия важнейшим структурам железоуглеродистых сплавов;
эти названия употребляются до сих пор. С тех пор учеными различных стран было выполнено огромное количество работ, посвященных изучению сплавов железа с углеродом и диаграммы состояния системы Fе—С. Такого рода работы проводятся и в настоящее время. В них уточняются положения линий на диаграмме состояния в связи с применением более чистых веществ и более точных и современных методов.
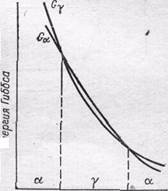
Температура плавления железа равна 1539 ± 5 °С. Железо образует две кристаллические модификации: α-железо и γ-железо. Первая из них имеет кубическую объемноцентрированную решетку, вторая — кубическую гранецентрированную. α-Железо термодинамически устойчиво в двух интервалах температур: ниже 912°С и от 1394 °С до температуры плавления. Между 912 и 1394 °С устойчиво γ-железо. Температурные интервалы устойчивости α- и γ-железа обусловлены характером изменения энергии Гиббса обеих модификаций при изменении температуры (см. рис. 166). При температурах ниже 912 и выше 1394 °С энергия Гиббса α-железа меньше энергии Гиббса γ-железа, а в интервале 912—1394 °С— больше.
Температуры фазовых превращений железа хорошо видны на кривой охлаждения в виде остановок—горизонтальных площадок. Как видно, кроме площадок, отвечающих 'перечисленным точкам, на кривой охлаждения имеется еще одна остановка—при 768 °С. Эта температура связана не с перестройкой решетки, а с изменением магнитных свойств железа. При темверату-рах выше 768 °С железо немагнитно, а ниже 768 °С — магнитно. Немагнитное α-железо иногда называют β-железом, а модификацию α-железа, устойчивую
при температурах от 1392°С до плавления,—δ-железом. '
Железо — серебристый пластичный металл. Оно хорошо поддается ковке, прокатке и другим видам механической обработки, Механические свойства железа сильно зависят от его чистоты — от содержания в нем даже весьма малых количеств других элементов.
|
|
Твердое железо обладает способностью растворять в себе многие элементы. В частности, растворяется в железе и углерод. Его растворимость сильно зависит от кристаллической модификации железа и от температуры. В α- железе углерод раствор очень незначительно, в γ- железе гораздо лучше. Раствор в γ- железе термодинамически устойчив в более широком интервале температур, чем чистое γ- железо. Твердый раствор углерода в α- железе называется ферритом, твердый раствор углерода в γжелезе — аустенитом.
Содержанию в железе 6,67% (масс.) углерода отвечает химическое соединение — карбид железа, или цементит, FeзС. Это вещество имеет сложную кристаллическую структуру и характеризуется высокой твердостью (близка к твердости алмаза) и хрупкостью. При температуре около 1600 °С цементит плавится *.
Механические свойства феррита и аустенита зависят от содержания в них углерода. Однако при всех концентрациях углерода феррит и аустенит менее тверды и более пластичны, чем цементит.
Диаграмма состояния системы железо—углерод, дающая представление о строении железоуглеродных сплавов, имеет очень большое значение. С ее помощью можно объяснить зависимость свойств сталей и чугунов от содержания в них углерода и от термической обработки. Она служит основой при выборе железоуглеродных сплавов, обладающих теми или иными заданными свойствами.
* Цементит термодинамически устойчив не при всех условиях, отвечающих диаграмме состояния системы Fе—С. Однако распад цементита, сопровождающийся выделением графита, в большинстве случаев протекает настолько медленно, что практически не осуществляется. Графит выделяется только при образовании чугуна в определенных условиях
Это самая важная часть диаграммы, поскольку практическое применение имеют сплавы железа, содержащие не более 5% углерода.
Диаграмма состояния системы Fе—С сложнее, чем рассмотренные в главе XVI основные типы диаграмм состояния металлических систем. Особенности ее обусловлены уже упомянутыми обстоятельствами: существованием двух модификаций кристаллического железа, способностью обеих этих модификаций
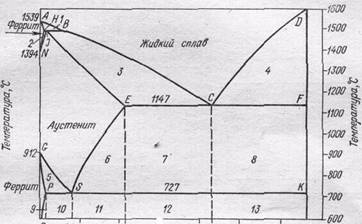
Рис. 168. Диаграмма состояния системы железо—углерод.
образовывать твердые растворы с углеродом, способностью железа вступать в химическое соединение с углеродом, образуя цементит.
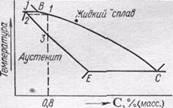
Левая ось диаграммы соответствует чистому железу, правая — карбиду FезС (цементиту). Точки A и D показывают температуру плавления железа и карбида, точки G и N—температуры превращений α- и γ- железа друг в друга.
Линия АВСD это кривая температур начала кристаллизации жидких сплавов, линия АНJЕСP — кривая температур начала плавления твердых сплавов. Все линии, лежащие ниже последней кривой, отвечают равновесиям между твердыми фазами.
Область, лежащая выше линии АВСD, отвечает жидкому сплаву. Области, примыкающие к левой вертикали, соответствуют твердым растворам углерода в железе: линия АНN ограничивает область твердого раствора углерода в α-железе при высоких температурах (область высокотемпературного феррита), линия NJESG ограничивает область твердого раствора углерода в γ-железе (область аустенита), линия GPQ — область твердого раствора углерода в α-железе при низких температурах (область низкотемпературного феррита). Перечисленным областям соответствуют гомогенные системы: структура как расплава, так и твердых растворов однородна в каждой из этих фаз.
Остальным областям диаграммы отвечают гетерогенные системы — смеси кристаллов двух фаз или кристаллов и расплава.
Рассмотрим важнейшие превращения, происходящие при медленном охлаждении расплавов различных концентраций. Это поможет нам разобраться в том, какие сплавы соответствуют областям гетерогенности диаграммы.
|
|
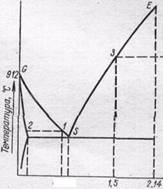
Пусть мы имеем расплав, содержащий 0,8% углерода. Его кристаллизация
начнется в точке 1 . При охлаждении расплава до температуры, отвечающей этой точке, будут выпадать кристаллы аустенита; их состав отвечает точке 2. Расплав при этом обогащается углеродом и его состав изменяется по линии ВС. Состав кристаллов в процессе кристаллизации изменяется но кривой JЕ. Когда состав кристаллов достигнет точки 3, кристаллизация закончится. Как всегда при образовании твердого раствора, одновременно идет процесс диффузии в твердой фазе, в результате чего при медленном охлаждении состав всех кристаллов получается одинаковым.
Далее, образовавшийся аустенит охлаждается без превращений 'до точки 5 . Эта точка (температура 727 °С) показывает минимальную температуру устойчивого существования аустенита. При 727 °С происходит его эвтектоидный распад *. Образующийся эвтектоид состоит из чередующихся мелких пластинок феррита и цементита. На изломе он при рассматривании под микроскопом напоминает перламутр. Поэтому эта структура—эвтектоидная смесь феррита и цементита — получила название перлит.
Если исходный расплав содержит не 0,8% углерода, а несколько меньше, например, 0,7%, то образующийся при кристаллизации аустенит начнет распадаться не при 727 °С, а при более высокой температуре (точка / на рис. 170). Превращение начнется с выделения кристаллов феррита, содержание углерода в котором очень мало. Вследствие этого остающийся аустенит обогащается углеродом и при дальнейшем охлаждении его состав изменяется по кривой GS. По достижении точки 5 начинается эвтектоидное превращение при постоянной температуре, по окончании которого сталь будет состоять из феррита и перлита. Из сказанного
* Эвтектоидный распад, приводящий к образованию эвтектоида, представляет собой процесс, аналогичный кристаллизации эвтектики. Различие состоит в том, что эвтектика образуется из расплава, т. е. жидкого раствора, а эвтектоид — из твердого раствора.
вытекает, что области 3 на диаграмме соответствует смесь жидкого сплава с кристаллами аустенита, области 5 — смесь кристаллов феррита и аустенита, и области 10 смесь — перлита с кристаллами феррита.
Если исходный расплав содержит более 0,8% углерода (но менее, чем 2,14%), например, 1,5%, то распад аустенита начнется с выделения цементита. Вследствие выделения FeзС — фазы, богатой углеродом, — остающийся аустенит обогащается железом, так что при дальнейшем охлаждении его состав изменяется по кривой ES. В точке 5 начинается выделение перлита. В итоге получается сталь со структурой, состоящей из цементита и перлита. Таким образом, области 6 на диаграмме отвечает смесь кристаллов цементита и аустенита, а области —смесь перлита с кристаллами цементита.
|
|
Обратимся теперь к сплавам, содержащим более 2,14% углерода. Первичная кристаллизация в этом случае заканчивается эвтектическим превращением при 1147°С, когда из расплава, содержащего 4,3% углерода (точка С), выделяется эвтектический сплав аустенита и цементита. Если при этом исходить из расплава эвтектического состава (4,3% С), то кристаллизация начнется и закончится при одной и той же температуре 1147°С. В случае сплавов, содержащих меньше 4,3% углерода (но больше 2,14%), образованию эвтектики будет предшествовать выделение аустенита. При содержании углерода выше 4,3% кристаллизация начнется с выделения цементита, но по достижении точки С на диаграмме также будет наблюдаться образование эвтектики. Таким образом, в результате кристаллизации жидких сплавов, содержащих более 2,14% углерода, первоначально получается структура, состоящая либо только из эвтектики, либо из эвтектики с кристаллами аустенита или цементита.
В то же время, как мы видели раньше, при кристаллизации жидких сплавов, содержащих меньше 2,14% углерода, первоначально получается аустенит. Это различие в структуре при высоких температурах создает различие в технологических и механических свойствах сплавов. Эвтектика делает сплавы нековкими, но ее низкая температура плавления облегчает применение высокоуглеродистых сплавов как литейных материалов. Железоуглеродные сплавы, содержащие меньше 2,14°/о углерода, называются сталями, а содержащие больше 2,14°/о углерода—чугунами. Эта граница (2,14% углерода) относится к железоуглеродным сплавам, не содержащим других элементов. В присутствии третьего элемента вид диаграммы состояния изменяется, в частности границы устойчивости аустенита в некоторых случаях смещаются в сторону низких температур.
Закончим рассмотрение превращений, совершающихся в чугу-нах, при их охлаждении ниже 1147 °С. При этой температуре растворимость углерода в у-железе максимальна. Поэтому к моменту окончания первичной кристаллизации содержащийся в чугуне аустенит наиболее богат углеродом (2,14%). При охлаждении ниже этой температуры растворимость углерода в аустените падает (кривая ЕS) и углерод выделяется из него, превращаясь обычно в цементит. По достижении температуры 727 °С весь остающийся аустенит, в том числе входящий в состав эвтектики, превращается в перлит. Из сказанного следует, что области 7 отвечает смесь эвтектики с кристаллами аустенита и цементита, образовавшегося при распаде аустенита, области 8—смесь эвтектики с кристаллами цементита. Поскольку при температурах ниже 727 °С аустенит эвтектики превращается в перлит, то областям 12 и 13, подобно области //, отвечает смесь перлита и цементита. Однако сплавы, принадлежащие к той и другой области, несколько различаются по структуре. Это различие обусловлено тем, что цементит сплавов области 13 образуется при первичной кристаллизации, в области 12—при распаде аустенита. Таким образом, при температурах ниже 727 °С чугун состоит из цементита и перлита. Как мы увидим ниже, в некоторых случаях чугун может иметь и другую структуру.
Рассматривая превращения, происходящие при охлаждении расплавов различного состава, мы смогли выяснить, какие сплавы соответствуют различным областям диаграммы. Но мы рассмотрели не все области диаграммы. Пользуясь тем же методом, нетрудно показать, какие сплавы отвечают остальным ее областям:
области 1 соответствует смесь жидкого расплава и кристаллов высокотемпературного феррита, области 2—смесь кристаллов высокотемпературного феррита и аустенита, области 4 — смесь жидкого сплава и кристаллов цементита, области 9 — смесь кристаллов феррита и цементита.
Производство чугуна и стали.
Железо имело промышленное применение уже до нашей эры. В древние времена его получали в размягченном пластичном состоянии в горнах, используя в качестве топлива древесный уголь. Шлак отделяли, выдавливая его из губчатого железа ударами молота.
Ч1о мере развития техники производства железа постепенно повышалась температура, при которой велся процесс. Металл и шлак стали плавиться; стало возможным разделять их гораздо полнее. Но одновременно в металле повышалось содержание углерода и других примесей,—металл становился хрупким и нековким. Так получился чугун.
•Позднее научились перерабатывать чугун; зародился двухступенчатый способ производства железа не руды. В принципе он сохраняется до настоящего времени: современная схема получения стали состоит из доменного процесса, в ходе которого из руды получается чугун, и сталеплавильного передела, приводящего к уменьшению в металле количества углерода и других примесей.
Современный высокий уровень металлургического производства основан на теоретических исследованиях и открытиях, сделанных в различных странах, и на богатом практическом опыте. Немалая роль в этом прогрессе принадлежит русским и советским ученым. Так, основоположником теории производства литой встали был П. П. Аносов. Академики А. А. Байков, М. А. Павлов, И. П. Баодин — авторы важнейших теоретических трудов по доменному и сталеплавильному производству.
В последние годы в нашей стране разработаны и внедрены новые технологические процессы выплавки чугуна и стали. Советские металлурги первыми широко применили природный газ для доменной плавки. У нас раньше, чем в США, были введены в строй современные доменные печи объемом 1300 м3, а сейчас действуют печи объемом 5000 м3.
За короткий исторический промежуток времени СССР вышел на второе место в мире по выпуску черных металлов.
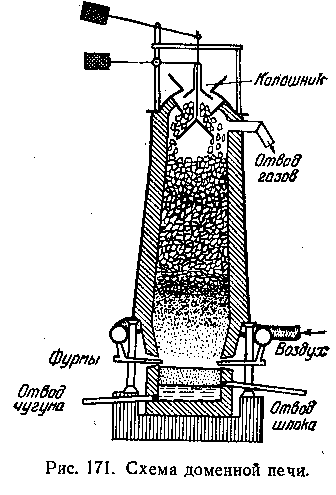
Выплавка чугуна производится в огромных доменных печах, выложенных из огнеупорных кирпичей и достигающих 30 м высоты при внутреннем диаметре около 12 м.
Разрез доменной печи схематически изображен. Верхняя ее половина носит название шахты и заканчивается наверху отверстием — колошником, которое закрывается подвижной воронкой — колошниковым затвором. Самая широкая часть печи называется распаром, а нижняя часть — горном. Через специальные отверстия в горне (фурмы) в печь вдувается горячий воздух или кислород.
Доменную печь загружают сначала коксом, а затем послойно агломератом и коксом. Агломерат—это определенным образом подготовленная руда, спеченная с флюсом (см. ниже). Горение и необходимая для выплавки чугуна температура поддерживаются вдуванием в горн подогретого воздуха или кислорода. Последний поступает в кольцевую трубу, расположенную вокруг нижней части печи,, а из нее по изогнутым трубкам через фурмы в горн. В горне КОКС сгорает, образуя СО2, который, поднимаясь вверх и проходя сквозь слои накаленного кокса, взаимодействует с ним и образует СО. Образовавшийся оксид углерода и восстанавливает большую часть руды, переходя снова в СО2.
Процесс восстановления руды происходит главным образом в верхней части шахты. Его можно выразить суммарным уравнением: Fe2O3+3CO=2Fe+3CO2
При восстановлении руды железо получается в твердом состоянии. Постепенно оно опускается более горячую часть печи — распар — и растворяет в себе углерод; образуется чугун Последний плавится и стекает в нижнюю часть горна, а жидкие шлаки собираются на поверхности чугуна, предохраняя его от окисления. Чугун и шлаки выпускают по мере накопления через особые отверстия, забитые в остальное время глиной.
Выходящие из отверстия печи газы содержат до 25% СО. Их сжигают в особых аппаратах— кауперах, предназначенных для предварительного нагревания вдуваемого в печь воздуха. Доменная печь работает непрерывно. По мере того как верхние слои руды и кокса опускаются.! в печь добавляют новые их порции.Смесь рудыи кокса доставляется подъемниками на верхнюю площадку печи и загружается в чугунную воронку, закрытую снизу колошниковым затвором. При опускании затвора смесь попадает в печь. Работа печи продолжается в течение нескольких лет, пока печь не требует капитального ремонта.
Процесс выплавки чугуна может быть уcкорен путем применения в доменных печах кислорода. При вдувании в доменную печь обогащенного кислородом воздуха предварительный подогрев его становится излишним, благодаря чему отпадает необходимость в сложных и громоздких кауперах и весь металлургический процесс значительно упрощается. Вместе с тем резко повышается производительность печи и уменьшается расход топлива. (Доменная печь, работающая на кислородном дутье, дает в 1,5 раза больше металла, а кокса требует на 1/4 меньше, чем при воздушном дутье.
Современная доменная печь — мощный и высокопроизводительный агрегат. В нем перерабатываются огромные количества материалов. В печи объемом 2000 м3 расходуется около 7000 т агломерата и 2000 т кокса в сутки. При этом получается 4000 т чугуна. Иначе говоря, в большой доменной печи ежеминутно выплавляется около 2,5 т чугуна.
Существует несколько способов переработки чугуна в сталь. Они основаны на окислении содержащегося в чугуне углерода и примесей и отделении образующихся оксидов в газовую фазу или в шлак. В СССР основная масса чугуна перерабатывается в сталь мартеновским способом.
Мартеновски й-'п р о ц е с с, разработанный французским инженером П. Мартеном, ведут в пламенной отражательной печи. В нее загружают чугун, а также стальной лом, требующий переплавки, и некоторое количество руды. В печь вводятся предварительно нагретые воздух и топливо (в виде газа или., распыленной жидкости). При сгорании топлива образуется факел с температурой 1800—1900 °С. Металл и руда плавятся, и в расплав (вводят добавки, необходимые для получения стали заданного состава. Выгорание примесей происходит главным образом за счет кислорода воздуха.
Небольшое количество стали выплавляют в конверторах. Сущность конверторного или, по фамилии изобретателя, бессемеровского метода состоит в продувании струи воздуха через расплавленный чугун. При этом углерод и примеси сгорают и удаляются в виде газов или переходят в шлак. Конвертор представляет собой сосуд грушевидной формы, поворачивающийся на горизонтальной оси. Заливка чугуна и выливание готовой стали производятся в горизонтальном положении конвертора, а продувка воздухом — в вертикальном.
Конверторный метод имеет ряд недостатков по сравнению с мартеновским. Качество бессемеровской стали ниже, чем мартеновской. Это объясняется тем, что в ходе дутья в металле растворяется заметное количество азота, что обусловливает склонность бессемеровской стали к старению — утрате с течением времени пластичности и возрастанию хрупкости. Бессемеровская сталь значительно лучшего качества получается при использовании кислородного дутья.
Наиболее совершенный промышленный способ получения стали — плавка в электрических печах. Этим способом выплавляют в настоящее время большинство сортов специальных сталей. В электрической печи легко обеспечивается быстрый подъем и точное регулирование температуры; в ней можно создавать окислительную, восстановительную или нейтральную атмосферу. Это позволяет получать сталь с наименьшим количеством вредных примесей; в то же время заданный состав стали обеспечивается с высокой точностью.
При всех процессах выплавки жидкая сталь содержит небольшое количество растворенного кислорода (до 0,1%). При кристаллизации стали кислород взаимодействует с растворенным углеродом, образуя оксид углерода (II). Этот газ (а также некоторые другие растворенные в жидкой стали газы), выделяется из стали в виде пузырей. Кроме того, по границам зерен стали выделяются оксиды железа и металлов примесей. Все это приводит к ухудшению/ме' ' ханических свойств стали.
Поэтому процесс выплавки стали обычно заканчивается ее раскислением — уменьшением количества растворенного в жидкой стали кислорода. Существуют различные способы раскисления стали. Чаще всего применяется добавка к стали небольших количеств элементов, активно соединяющихся с кислородом. Обычно в качестве раскислителей применяют марганец, кремний, алюминий, титан. Образующиеся оксиды этих элементов переходят в шлак.
Хорошо раскисленная сталь застывает спокойно — без газовые деления—и называется спокойной. При застывании нераскислен-ной или неполностью раскисленной стали из нее выделяются газы, и металл как бы кипит; такая сталь называется кипящей. Спокойная сталь лучше кипящей. Однако кипящие стали дешевле и также находят применение.
Выплавленную сталь выпускают в разливочный ковш и разливают в металлические формы — изложницы или направляют на непрерывную разливку. После затвердевания сталь получается в виде слитков.
При кристаллизации сталь уменьшается в объеме. Поэтому в верхней части слитка, затвердевающей в последнюю очередь, образуется пустота, называемая усадочной раковиной. Область слитка, расположенная ниже усадочной раковины обладает рыхлой структурой. В слитках кипящей стали усадочная рaковина не образуется, но зато они пронизаны большим количеством пузырей. Слиткам присущи и другие дефекты, в частности неоднородность химического Состава. Она обусловлена тем, что кристаллы, образующиеся в первую очередь, содержат минимальное количество примесей, а последние порции кристаллизующейся стали максимально обогащены имя; диффузия же атомов примесей, которая могла бы выравнять их концентрации, происходить не успевает, потому что слиток охлаждается быстро.
Для устранения дефектов слитков большая часть всей выплавляемой стали (около 90%) обрабатывается давлением. При этом структура стали делается значительно более однородной, в результате чего ее механические свойства улучшаются.
Процессы обработки давлением разнообразны. К ним принадлежат прокатка, волочение, прессование и другие. Важнейший вид обработки давлением это прокатка. Слитки, поступающие в прокатный цех металлургического завода, нагреваются до 1000—1300 °С. При этом сталь переходит в состояние аустенита и ее пластичность сильно возрастает. Нагретые слитки поступают на прокатный стан. Он представляет собой комплекс машин, главное значение которых состоит в деформации металла с помощью вращающихся валков. Захватываемый валками слиток подвергается обжатию. При этом толщина заготовки уменьшается, а длина увеличивается; операция повторяется многократно. Различные прокатные станы дают возможность получать разнообразную продукцию: листы, трубы, рельсы, балки, изделия более сложной формы, например, железнодорожные колеса. Часть стали прокатывается не до получения готовой продукции, а лишь до полупродукта (листы, прутки и др.). Такой полупродукт в дальнейшем проходит обработку другими методами. Горячекатанная сталь—наиболее употребительный материал для производства'"машин, станков, строительных металлоконструкций. предметов широкого потребления.
Термическая обработка стали. Термической (тепловой) обработкой стали называется изменение ее структуры, а следовательно, и свойств, достигаемое нагреванием до определенной температуры, выдерживанием при этой температуре и охлаждением с заданной скоростью. Термическая обработка стали — важнейшая операция в технологии стали; она может очень сильно изменить свойства стали. Ей подвергают как готовые изделия, главным образом инструменты и детали машин, так и полуфабрикаты, например, отливки, прокат.
Применяются различные виды термической обработки, придающие стали различные свойства. Важнейшими являются закалка и отпуск.
Закалка осуществляется нагреванием стали до температуры, несколько превышающей температуру превращения перлита в аустенит, выдержкой при этой температуре и быстрым охлаждением. Закалка придает стали твердость, прочность, но в то же время делает ее хрупкой. Поэтому закаленную сталь обычно подвергают еще одной операции — отпуску. Он состоит в нагревании стали до температуры, при которой еще не достигается превращение в аустенит, выдержке при этой температуре и сравнительно медленном охлаждении. Отпуск — конечная операция термической обработки. В результате закалки и отпуска, проводимых по заданному режиму, сталь получает требуемые механические свойства.
|
|
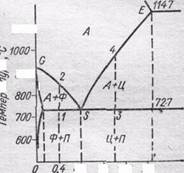
Что представляют собой те процессы, которые протекают в стали при закалке и отпуске? Для ответа на этот вопрос вспомним диаграмму состояния системы Fе—С. приведена часть этой диаграммы, отвечающая содержанию углерода до 2,14% и температуре до 1147°С. При нагревании стали эвтектоидного состава (0,8% углерода) перлит при 727 °С превращается в аустенит. При нагревании стали, содержащей меньшие количества углерода, например, 0,4% (структура такой стали состоит из перлита и феррита), при 727 °С перлит превращается в аустенит с
0,8% углерода (точка / на рис. 173), а при дальнейшем нагревании феррит постепенно растворяется в аустените; содержание углерода в аустените при этом уменьшается в соответствии с линией 50. По достижении точки 2 феррит исчезает, а концентрация углерода в аустените становится равной его общему содержанию в стали.
Аналогично протекают превращения в случае стали, содержащей большие количества углерода, например, 1,4%. Такая сталь состоит из перлита и цементита. При 727 °С перлит превращается в аустенит, содержащий 0,8% углерода (точка 3), а при дальнейшего нагревании цементит растворяется в аустените. По достижении точки 4 цементит исчезает, а содержание углерода в аустените становится равным 1,4%.
Таким образом, первый этап закалки—нагревание сопровождается переходом стали в состояние аустенита. Диффузия атомов даже при высоких температурах происходит в твердом теле далеко не мгновенно. Для полноты превращения сталь выдерживают некоторое время при температуре, немного превышающей соответствующую точку на линии GS или SЕ.
Процессы, протекающие при медленном охлаждении аустенита, обратны только что рассмотренным. Но при быстром его охлаждении эти процессы, связанные с диффузией атомов углерода и железа, не успевают происходить. В результате сталь оказывается в неравновесном состоянии.
При охлаждении аустенит делается термодинамически неустойчивой фазой;
при температурах ниже 727 °С термодинамически устойчив перлиг или перлит с избытком феррита или цементита. Чем больше переохлаждение, тем больше разность энергий Гиббса аустенита и перлита, стимулирующая превращение. Но, в то же время, чем больше переохлаждение (т. е. чем ниже температура), тем медленнее протекает диффузия атомов. В результате одновременного действия этих противоположных тенденций скорость превращения аустенита в перлит оказывается максимальной при небольших переохлаждениях, т. е. при медленном понижении температуры. При больших же переохлаждениях, при быстром снижении температуры скорость диффузионных процессов приближается к нулю и превращение становится невозможным. Однако кристаллическая решетка железа перестраивается при любой скорости охлаждения, так что в результате 'понижения температуры γ-железо превращается в α-железо. Таким образом, в основе закалки стали лежит превращение аустенита в пересыщенный твердый раствор углерода в α-железе. Эта фаза носит название мартенсита; будучи термодинамически неустойчивой, она не находит отражения на диаграмме состояния.
Если в равновесном состоянии растворимость углерода в α-железе при 20 "С не превышает 0,0025%, то в мартенсите его содержится столько же, сколько в исходном аустените. Мартенситное превращение не сопровождается диффузионным перераспределением углерода, т. е. перемещения атомов углерода и железа не превышают в ходе этого превращения межатомных расстояний. Происходит лишь перестройка кубической гранецентрированной решетки γ-железа в кубическую объемноцентрированпую (α-железо). Однако сохранение в новой решетке атомов углерода приводит к ее искажению, а точнее говоря, к превращению в тетрагональную с отношением осей, незначительно отличающимся от единицы. При содержании углерода в стали выше 0,5% часть аустенита не испытывает превращения и сохраняется в закаленной стали.
Мартенсит обладает высокой твердостью, возрастающей с увеличением содержания углерода. Его твердость обусловлена очень тонкой неоднородностью строения, препятствующей передвижению дислокации. Но в то же время, в связи с большими внутренними напряжениями, возникающими при его образовании, мартенсит хрупок. Поэтому закаленная сталь тверда, но хрупка.
При отпуске мартенсит и остаточный аустенит частично распадаются. При этом степень превращения мартенсита и структура образующихся продуктов зависят от температуры нагрева при отпускею.
При низкотемпературном отпуске изделия нагревают до 150— 250 °С. При этом углерод лишь частично выделяется из мартенсита, образуя включения пластинок карбида железа (цементита). Низкотемпературный отпуск снижает внутренние напряжения в стали, повышает ее прочность, а ее твердость и износостойкость сохраняются. Этому виду отпуска подвергают режущие 'и измерительные инструменты.
Среднетемпературный отпуск проводится при 350—500 °С. При этих температурах диффузия атомов углерода и железа протекает достаточно быстро; углерод полностью выделяется из мартенсита и сталь приобретает структуру феррита и тонкопластинчатых частиц цементита. Она становится упругой, в связи с чем среднетемпературному отпуску подвергают пружины и рессоры.
Отпуск, проводимый при 500—680 "С, называется высокотемпературным, или высоким. При этих температурах происходит рост кристаллитов карбида железа — тонкие пластинки его укрупняются и приобретают округлую форму. Высокий отпуск повышает вязкость стали; прочность и твердость ее немного снижаются, но остаются все же значительными. При высоком отпуске создается наилучшее соотношение механических свойств стали. Поэтому закалка с высоким отпуском называется улучшением стали. Улучшение — основной вид термической обработки конструкционных сталей .
В некоторых случаях поверхность изделия или детали должна обладать механическими свойствами, отличными от свойств в ее массе. Например, автомобильная ось должна иметь твердую поверхность, хорошо сопротивляющуюся истиранию, и в то же время не быть хрупкой, т е. обладать известной упругостью во избежание поломвк при толчках. В таких случаях применяется . химико-термическая обработка стали. При химико-термической обработке поверхность изделия насыщается .углеродом, азотом или некоторыми другими элементами, что достигается диффузией элемента из внешней среды при повышен ных температурах. Насыщение углеродом, или цементация, осуществляется нагреванием изделия в атмосфере СО, СН4 или в массе активного угля. При этом поверхностный слой стали глубиной 0,5—2 мм приобретает большую твердость и прочность, тогда как остальная масса стали остается вязкой и упругой. При азотировании стали, т. е. насыщении ее поверхности азотом, изделие подвергают длительному нагреванию в атмосфере аммиака при 500—600 "С. Азотированная сталь обладает еще большей твердостью, чем цементированная, вследствие образования в поверхностном слое нитридов железа. Она выдерживает нагревание до 500 "С, не теряя своей твердости.
Сплавы железа. Как уже говорилось, сплавы железа с углеродом делятся на стали и чугуны. Стали, в свою очередь, подразделяются на группы по своему химическому составу и по назначению, а чугуны—по тому, в каком состоянии находится в них углерод.
По химическому составу стали делятся на углеродистые и легированные. '
Углеродистые стали — это сплавы железа с углеродом,, причем содержание последнего не превышает 2,14%. Однако в углеродистой стали промышленного производства всегда имеются примеси многих элементов. Присутствие одних примесей обусловлено особенностями производства стали: например, при раскислении в сталь вводят небольшие количества марганца или кремния, которые частично переходят в шлак в виде оксидов, а частично остаются в стали. Присутствие других примесей обусловлено тем, что они содержатся в исходной руде и в малых количествах переходят в чугун, а затем и в сталь. Полностью избавиться от них трудно. Вследствие этого, например, углеродистые стали обычно содержат 0,05—0,1% фосфора и серы.
Механические свойства медленно охлажденной углеродистой стали сильно зависят от содержания в ней углерода. Медленно охлажденная сталь состоит из феррита и цементита, причем количество цементита пропорционально содержанию углерода. Твердость цементита намного выше твердости феррита. Поэтому при увеличении содержания углерода в стали ее твердость повышается. Кроме того, частицы цементита затрудняют движение дислокации в основной фазе — в феррите. По этой причине увеличение количества углерода снижает пластичность стали.
Углеродистая сталь имеет очень широкое применение. В зависимости от назначения применяется сталь с малым или с более высоким содержанием углерода, без термической обработки (в «сыром» виде — после проката) или с закалкой и отпуском. '
Легированные стали. Элементы, специально вводимые в сталь в определенных концентрациях для изменения ее свойств, называются легирующими элементами, а сталь, содержащая такие элементы, называется легированной сталью. К важнейшим легирующим элементам относятся хром, никель, марганец, кремний, ванадий, молибден.
Различные легирующие элементы по-разному изменяют структуру и свойства стали. Так, некоторые элементы образуют твердые растворы в γ-железе, устойчивые в широкой области температур. Например, твердые растворы марганца или никеля в γ-желсзе при значительно содержании этих элементов стабильны от комнатной температуры до температуры плавления. Сплавы железа с подобными металлами .называются поэтому аустенитными сталями или аустенитными сплавами.
Влияние легирующих элементов на свойства стали обусловлено также тем, что некоторые из них образуют с углеродом карбиды, которые могут быть простыми, например, МnзС, Сr7Сз, а также сложными (двойными), например, (Fе, Сг)зС. Присутствие карбидов, особенно в виде дисперсных включений в структуре стали, в ряде случаев оказывает сильное влияние на ее механические и физико-химические свойства.
По своему назначению стали делятся на конструкционные, инструментальные и стали с особыми свойствами. Конструкционные стали применяются для изготовления деталей машин, конструкций и сооружений. В качестве конструкционных могут использоваться как углеродистые, так и легированные стали. Конструкционные стали обладают высокой прочностью и пластичностью. В то же время они должны хорошо поддаваться обработке давлением, резанием, хорошо свариваться. Основные легирующие элементы конструкционных сталей это хром (около 1%), никель (1—4%) и марганец (1—1,5%).
Инструментальные стали — это углеродистые и легированные стали, обладающие высокой твердостью, прочностью и износостойкостью. Их применяют для изготовления режущих и измерительных инструментов, штампов. Необходимую твердость обеспечивает содержащийся в этих сталях углерод (в количестве от 0,8 до 1,3%). Основной легирующий элемент инструментальных сталей—хром; иногда в них вводят также вольфрам и ванадии. Особую группу инструментальных сталей составляет быстрорежущая сталь, сохраняющая режущие свойства при больших скоростях резания, когда температура рабочей части резца повышается до 600—700 °С. Основные легирующие элементы этой стали — хром и вольфрам.
Стали с особыми свойствами. К этой группе относится нержавеющие, жаростойкие, жаропрочные, магнитные и некоторые другие стали. Нержавеющие стали устойчивы против коррозии в атмосфере, влаге и в растворах кислот, жаростойкие — в коррозионно-активных средах при высоких температурах. Жаропрочные стали сохраняют высокие механические свойства при нагревании до значительных температур, что важно при изготовлении лопаток газовых турбин, деталей реактивных двигателей и ракетных установок. Важнейшие легирующие элементы жаропрочных сталей это хром (15—20%), никель (8—15%), вольфрам. Жаропрочные стали принадлежат к аустенитным сплавам.
Магнитные стали используют для изготовления постоянных магнитов и сердечников магнитных устройств, работающих в переменных полях. Для постоянных магнитов применяют высокоуглеродистые стали, легированные хромом или вольфрамом. Они хорошо намагничиваются и длительное время сохраняют остаточную индукцию. Сердечники магнитных устройств изготовляют из низкоуглеродистых (менее 0,005% С) сплавов железа с кремнием. Эти стали легко перемагничиваются и характеризуются малым значением электрических потерь.
Для обозначения марок легированных сталей используется буквенно-цифровая система. Каждый легирующий элемент обозначается буквой: Н—никель, Х — хром, Г — марганец и др. Первые цифры в обозначении показывают содержание углерода в стали (в сотых долях процента). Цифра, идущая после буквы, указывает содержание данного элемента (при его содержании около 1% или менее цифра не ставится). Например, сталь состава 0,10—0,15% углерода и 1,3—1,7% марганца обозначается 12Г2. Марка Х18Н9 обозначает сталь, содержащую 18% хрома и 9% никеля. Кроме этой системы иногда применяют и нестандартные обозначения.
Чугун отличается от стали своими свойствами. Он в очень малой степени способен к пластической деформации (в обычных условиях не поддается ковке), но обладает хорошими литейными свойствами. Чугун дешевле стали.
Как уже говорилось, при кристаллизации жидкого чугуна, а также Ври распаде аустенита, содержащийся в этих фазах углерод обычно выделяется в виде цементита. Однако в рассматриваемых условиях цементит термодинамически неустойчив. Его образование обусловлено только тем, что зародыши его кристаллизации образуются гораздо легче и требуют меньших диффузионных изменений, чем зародыши графита. Поэтому в условиях очень медленного охлаждения жидкого чугуна углерод может кристаллизоваться не в виде цементита, а в виде графита. Образование графита сильно облегчается также в присутствии мелких частиц примесей (особенно примесей графита) в расплавленном чугуне.
Таким образом, в зависимости от условий кристаллизации, чугун может содержать углерод в виде цементита, графита или в виде их смеси. Форма образующегося графита также может быть различной.
Белый чугун содержит весь углерод в виде цементита. Он обладает высокой твердостью, хрупок, и поэтому имеет ограниченное применение. В основном он выплавляется для передела на сталь.
В сером чугуне углерод содержится главным образом в виде пластинок графита. Серый чугун характеризуется высокими литейными свойствами (низкая температура кристаллизации, текучесть в жидком состоянии, малая усадка) и служит основным материалом для литья. Он широко применяется в машиностроении для отливки станин станков и механизмов, поршней, цилиндров. Кроме углерода, серый чугун всегда содержит другие элементы. Важнейшие из них — это кремний и марганец. В большинстве марок серого чугуна содержание углерода лежит в пределах 2,4—3,8%, кремния 1—4% и марганца до 1,4%.
Высокопрочный чугун получают присадкой к жидкому чугуну некоторых элементов, в частности, магния, под влиянием которого графит при кристаллизации принимает сферическую форму. Сферический графит улучшает механические свойства чугуна. Из высокопрочного чугуна изготовляют коленчатые валы, крышки цилиндров, детали прокатных станов, прокатные валки, насосы, вентили.
Ковкий чугун получают длительным нагреванием отливок из белого чугуна. Его применяют для изготовления деталей, работающих при ударных вибрационных нагрузках (например, картеры, задний мост автомобиля). Пластичность и прочность ковкого чугуна обусловлены тем, что углерод находится в нем о форме хлопьевидного графита.
Химические свойства железа. Соединения железа.
Железо- металл средней химической активности. В отсутствие влаги в обычных условиях пассивируется, но во влажном воздухе легко окисляется и покрывается ржавчиной. При нагревании (в особенности в мелкораздробленном состоянии) взаимодействует почти со всеми неметаллами. При этом в зависимости от условий и активности неметалла образуются твердые растворы( с C, Si, N, B, P, H), металлоподобные ( Fe3C, Fe3Si, Fe4N, Fe2N) или солеподобные ( FeF3, FeCI3, FeS) соединения. Окисление железа кислородом приводит к образованию оксидов нестехиометрического состава.
Чистое железо получают различными методами. Наибольшее значение имеют метод термического разложения пентакарбонила железа и электролиз водных растворов его солей.
Во влажном воздухе железо быстро ржавеет, т. е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления. В воде железо интенсивно корродирует; при обильном доступе кислорода образуются гидратные формы оксида железа(ІІI):
2Fe+3/2O2+nH2O=Fe2O3• nH2O
При недостатке кислорода или при его затрудненном доступе образуется смешанный оксид Fез04
(FеО • Fe2Оз):
ЗFе + 202 + 2Н2О = Fез04 • nН2О Железо растворяется в соляной кислоте любой концентрации:
Fе + 2НС1 = FеС12 + Н2 ↑
Аналогично происходит растворение в разбавленной серной кислоте:
Fe+H2SO4=FeS04+H2 ↑
В концентрированных растворах серной кислоты железо окисляется до железа(III):
2Fе + 6Н2S04 = Fе2(SO4)3 + 3SO2 ↑ + 6Н2О
Однако в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействия практически не происходит.
В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:
Fе + 4НNОз = Fе(NOз)з + N0 ↑ + 2Н20
При высоких концентрациях НNОз растворение замедляется и железо становится пассивным.
Для железа характерны два ряда соединений: соединения железа (II) и соединения железа (III). Первые отвечают оксиду железа(II), или закиси железа, FеО, вторые—оксиду железа (III), или окиси железа, Fе2О3. Кроме того, известны соли железной кислоты Н2Fе04, в которой степень окисленности железа равна +6.
Соединения железа(II). Соли железа(II) образуются при растворении железа в разбавленных кислотах, кроме азотной. Важнейшая из них—сульфат железа(\), или железный купорос,FeSO4•7H2O , образующий светло-зеленые кристаллы, хорошо растворимые в воде. На воздухе железный купорос постепенно выветривается и одновременно окисляется с поверхности, переходя в желто-бурую основную соль железа (III).
Сульфат железа (II) получают путем растворения обрезков стали в 20—30% -пой серной кислоте:
Fе + Н2S04 = FеS04 + Н2 ↑
Сульфат железа (II) применяется для борьбы с вредителями растений, в производстве чернил и минеральных красок, при крашении тканей.
При нагревании железного купороса выделяется вода и получается белая масса безводной соли Ре804. -При температурах выше 480 °С безводная соль разлагается с выделением диоксида и триоксида серы; последний во влажном воздухе образует тяжелые белые пары серной кислоты:
2FеS04 == Fе2О3 + S02 ↑ + S0з↑
При взаимодействии раствора соли железа (II) со щелочью выпадает белый осадок гидроксида железа(II) Fе(ОН)2, который на воздухе вследствие окисления быстро принимает зеленоватую, а затем бурую окраску, переходя в гидроксид железа(III) Fе(ОН)з:
4Fе(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3
Безводный оксид железа(\) FеО можно получить в виде черного легко окисляющегося порошка восстановлением оксида железа(III) оксидом углерода (II) при500°С:
Fе2О3 + СО == 2FеО + C02
Карбонаты щелочных металлов осаждают из растворов солей железа (II) белый карбонат железа(\) FеСОз. При действии воды, содержащей СО2, карбонат железа, подобно карбонату кальция, частично переходит в более растворимую кислую соль Fе(НСОз)2. В виде этой соли железо содержится в природных железистых водах.
Соли железа (II) легко могут быть переведены в соли железа(III) действием различных окислителей—азотной кислоты, перманганата калия, хлора, например:
6FeSO4+2HNO3+3H2SO4=3Fe2(SO4)3+2NO ↑ +4H2O
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3 +K2SO4+2MnSO4+8H2O
Ввиду способности легко окисляться, соли железа (II) часто применяются как восстановители.
Соединения железа (III). Хлорид железа(III) FеСIз представляет собой темно-коричневые с зеленоватым отливом кристаллы. Это вещество сильно гигроскопично; поглощая влагу из воздуха, оно превращается в кристаллогидраты, содержащие различное количество воды и расплывающиеся на воздухе. В таком состоянии хлорид железа (III) имеет буро-оранжевый цвет. В разбавленном растворе FеСIз гидролизуется до основных солей. В парах хлорид железа(III) имеет структуру, аналогичную структуре хлорида алюминия и отвечающую формуле Fе2СI6; заметная диссоциация Fе2СI6 на молекулы FеСIз начинается при температурах около 500 °С.
Хлорид железа (III) применяют в качестве коагулянта при очистке воды, как катализатор при синтезах органических веществ, в текстильной промышленности.
Сульфат железa(III) Fе2(S04)3 — очень гигроскопичные, расплывающиеся на воздухе белые кристаллы. Образует кристаллогидрат Fе2(S04)3 . 9Н20 (желтые кристаллы). В водных растворах сульфат железа (III) сильно гидролизован. С сульфатами щелочных металлов и аммония он образует двойные соли — квасцы, например, железоаммонийные квасцы (NН4)Fе(SO4)2 •12Н2О—хорошо растворимые в воде светло-фиолетовые кристаллы. При прокаливании выше 500 °С сульфат железа (III) разлагается в соответствии с уравнением:
Fе2(S04)3 == Fе2О3 + ЗSО3 ↑
Сульфат железа (III) применяют, как и FеСI3, в качестве коагулянта при очистке воды, а также для травления металлов. Раствор Fе2(S04) способен растворять Сu2S и СuS с образованием сульфата меди(II); это используется при гидрометаллургическом получении меди.
При действии щелочей на растворы солей железа (III) выпадает красно-бурый гидроксид железа(III) Fе(ОН)з, нерастворимый в избытке щелочи.
Гидроксид железа(III)—более слабое основание, чем гидроксид железа (II); это выражается в том, что соли железа(III) сильно гидролизуются, а со слабыми кислотами (например, с угольной, сероводородной) Fе(ОН)з солей не образует. Гидролизом объясняется и цвет растворов солей железа (III): несмотря на то, что ион Fе3+ почти бесцветен, содержащие его растворы окрашены в желто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fе(ОН)з, которые образуются благодаря гидролизу:
Fe3++H2O ↔ FeOH2+ + H+
FeOH2+ + H2O ↔ Fe(OH)+2 + H+
Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза.
При прокаливании гидроксид железа(III), теряя воду, переходит в оксид железа(III), или окись железа, Fе2О3. Оксид железа (III) встречается в природе в виде красного железняка и применяется как коричневая краска — железный сурик, или мумия.
Характерной реакцией, отличающей соли железа (III) от солей железа (II), служит действие роданида калия КSСN или роданида аммония NН4SСN на соли железа. Раствор роданида калия содержит бесцветные ионы SСN-, которые соединяются с ионами Fе(III), образуя кроваво-красный, слабо диссоциированный роданид железа(III) Fе(SСN)3. При взаимодействии же с роданидами ионов железа (II) раствор остается бесцветным.
Цианистые соединения железа. При действии на растворы солей железа (II) растворимых цианидов, например цианида калия, получается белый осадок цианида железа (II);
Fе2+ + 2СN- == Fе(СN)2↓
В избытке цианида калия осадок растворяется вследствие образования комплексной соли K4[Fе(СN)6]—гексациано-(II)феррата калия
Fe(CN)2 + 4KCN=K4[Fe(CN)6]
Fe(CN)2 + 4CN- = [Fe(CN)6]4-
Гексациано-(II)феррат калия К4[Fе (СN)6] • 3Н2О кристаллизуется в виде больших светло-желтых призм. Эта соль называется также желтой кровяной солью. При растворении в воде соль диссоциирует на ионы калия и чрезвычайно устойчивые комплексные ионы [Fе (СN) 6]4-. Практически такой раствор совершенно не содержит ионов Fе3+ и не дает реакций, характерных для железа(II),
Гексациано-(II) феррат калия служит чувствительным реактивом на ионы железа (III), так как ионы [Fе (СМ) 6]4-, взаимодействуя с ионами Fе3+ , образуют нерастворимую в воде соль гекса-циано-(II)феррат железа (III) Fе4[(Fе(СN)6]3 характерного синего цвета; эта соль получила название берлинской лазури:
4Fе + 3[Fе(СN)6]4- = Fе4[Fе(СN)6]3
Берлинская лазурь применяется в качестве краски. При действии хлора или брома на раствор желтой кровяной соли анион ее окисляется, превращаясь в ион [Fе(СN) 6]3- :
2[Fе(СN)6]4- + СI2 = 2[Fе(СN)6]3- + 2СI-
Соответствующая этому аниону соль К3[Fе (СN)6] называется гексациано-(III) феррaтом калия, или красной кровяной солью. Она образует красные безводные кристаллы.
Если подействовать гексациано-(III)ферратом калия на раствор соли железа (II), то получается осадок гексациано-(III)феррата железа (II) {турнбулева синь}, внешне очень похожий на берлинскую лазурь, но имеющий иной состав *:
ЗFе2+ + 2[Fе(СN)6]3+ = Fе3 [Fе(СN)6]2
С солями железа(III) Кз[Fе(СN)6] образует зеленовато-бурый раствор.
В большинстве других комплексных соединений, как и в рассмотренных цианоферратах, координационное число железа (II) я железа (III) равно шести.
Ф е р р и т ы. При сплавлении оксида железа (III) с карбонатами натрияили калия образуются ферриты — соли не полученной в свободном состоянии железистой кислоты НFе02, например, феррит натрия NаFеО2:
Fе2О3 + Nа2СО3 = 2NаFеO2 + СО2
В технике ферритами или ферритными материалами называют продукты спекания порошков оксида железа (III) и оксидов некоторых двухвалентных металлов, например, никеля, цинка, марганца. Спекание производится при1000—1400 "С. Ферриты обладают ценными магнитными свойствами и высоким электрическим сопротивлением, что обусловливает небольшую величину электрических потерь в них. Ферриты широко применяются в технике связи, счетно-решающих устройствах, в автоматике и телемеханике.
Соединения железа (VI). Если нагревать стальные опилки или оксид железа (III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррaт калия К2Fе04 — соль железной кислоты Н2Fе04:
Fе2О3 + 4КОН + ЗКNО3 = 2К2Fе04 + ЗКNO3 + 2Н20
При растворении сплава в воде получается красно-фиолетовый раствор, из ' которого действием хлорида бария можно осадить нерастворимый в воде феррат бария ВаFе04.
Все ферраты — очень сильные окислители (более сильные, чем перманга-иаты). Соответствующая ферратам железная кислота Н2FеО4 и ее ангидрид FеО3) в свободном состоянии не получены
Карбонилы железа. Железо образует летучие соединения с оксидом углерода, называемые карбонилами железа. Пентакарбонил железа Fе(СО)5 представляет собой бледно-желтую жидкость, кипящую при 105 °С, нерастворимую в воде, но растворимую во многих органических растворителях. Fе(СО)5 получают пропусканием СО над порошком железа при 150—200 °С и давлении 10 МПа, Примеси, содержащиеся в железе, не вступают в реакции с СО, вследствие чего получается весьма чистый продукт. При нагревании в вакууме пентакарбонил железа разлагается на железо и СО; это используется для получения высокочистого порошкового железа — карбонильного железа.
Биологическая роль железа, применение его соединений в медицине.
В организме человека содержится 5г железа. Большая часть его сосредоточена в гемоглобине крови (70%). Железо входит также в состав ферментов, например цитохромо, каталазы, пероксидазы и др. В связанной форме железо находится в некоторых белках, которые выполняют в организме роль переносчиков железа.
Одним из наиболее важных внутрикомплексных соединений, которые создала природа является гемоглобин. Это сложный по составу белок, содержащий и небелковую(простетическую) группу- ген, на долю которой приходится около 4% гемоглобина.
Простетическая группа представляет собой бионеорганический комплекс Fe(II) с полициклическим органическим веществом - порфирином. Эта группа носит название гем(от греч. гема - кровь). Гем имеет плоскостное строение.
Железо в геме имеет и шестую орбиталь, которая в гемоглобине используется в процессе связывания кислорода. Эта же орбиталь участвует в образовании связи с углеродом монооксидом. Доказано, что пятая и шестая связи перпендикулярны к плоскости порфириного кольца.
Как уже отмечалось, физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин обозначить Hb Fe2+ , то реакция обратимого присоединения можно записать так:
[Hb Fe2+ ] + O2 ↔ [Hb Fe2+ • O2]
дезоксигемоглобин оксигемоглобин
Гемоглобин, присоединивший кислород называется оксигемоглобин, а без кислорода-дезоксогемоглобином.
Гемоглобин взаимодействует с углеродом монооксидом, который в быту известен, как угарный газ. При этом образуется макроциклический комплекс с железом- карбонилгемоглобин: [Hb Fe2+ ] + СО [Hb Fe2+ • СО] константа этого комплекса приблизительно в 100 раз больше, чем комплекса железа с кислородом в геме. Поэтому при вдыхании углерода монооксиде большая часть гемоглобина переходит в карбонилгемоглобин, что и нарушает перенос кислорода от легких к тканям и вызывает отравление организма.при значительном увеличении парцмального давления кослорода равновесие сместится в сторону разрушения HbFe • СО и большего образования оксигемоглобина [Hb Fe] • O2.
Структуру подобную гемоглобину имеет и миоглобин (Mb). Он обратимо связывает кислород в мышцах, по механизму действия сходен с гемоглобиом и относится к гемосодержащим белкам:
 MbFe2+ + O2 MbFe 2+ • О2
MbFe2+ + O2 MbFe 2+ • О2
Дезоксиформа оксиформа
Существует большая группа железосодержащих ферментов, которые катализируют процесс переноса электронов в митохондриях, это так называевые цитохромы (ЦХ). Всего известно около 50 цитохром. Наиболее изученным считается цитохром С. Доказано, что перенос электронов в окислительно-восстановительной цепи с участием этого фермента осуществляется за счет изменения состояния железа:
ЦХFe3+ + e ↔ ЦХFe2+
Группа ферментов, катализирующих реакций и окисления водородпероксидом, называются каталазами и пероксидами. Они также имеют в своей структуре гем, в центре которого находится Fe3+ . Механизм действия каталазы до конца не ясен, но доказано, что Fe3+
не восстанавливается. Каталаза ускоряет разложение водородпероксида, который образуется в реакциях метаболизма:
 Н2О2 + Н2О2
каталаза 2Н2О +О2
Н2О2 + Н2О2
каталаза 2Н2О +О2
В этой реакции одна молекулаН2О2 является окислителем, другая – восстановителем. Реакция идет с большой скоростью, одна молекула каталазы может разложить 44000 молекул Н2О2 в одну секунду.
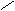 Фермент пероксидаза ускоряет реакции
окисления органических веществ (RH) водородпероксидом по
схеме:
Фермент пероксидаза ускоряет реакции
окисления органических веществ (RH) водородпероксидом по
схеме:


 Н2О2
+ Н2О• RН
пероксидаза 3Н2О
2Н2О + R
Н2О2
+ Н2О• RН
пероксидаза 3Н2О
2Н2О + R
В органах и тканях имеется так называемое депонированное (запасенное) железо, которое используется, если возникает дефицит железа. Депонируется оно с помощью белка- ферритина, который представляет мобой биопластер с молекулярной массой 460000.
В организме железо может транпортироваться в виде аминокислотных комплексов, которые образуются за счет координационной связи железа с азотом пептидных групп. Образование таких бионеорганических комплексов делает возможным прохождение ионов через клеточные мембраны. Как известно, пептидный слой оболочки клетки затрудняет прохождение ионов металлов в виде акваионов. А если ион металла находится в окружении органических легандов, то он достаточно легко проходит через клеточную мембрану.
Железо также транспортируется в виде железосодержащих белков, например, транссерринов. В механизме действия транссеррина многое остается дискуссионным, но доказано, что транссеррин отдает железо в виде Fe3+ . Функция транссеррина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется синтез гемоглобина.
Список используемой литературы:
1.«Общая химия» Ю. А. Ершов.
2. «Общая химия» Н.Г. Глинка.
3. «Общая и неорганическая химия» Н.С. Ахметова.
4. «Репетитор по химии» А.С. Егорова.