Аномалии воды
| Примечание | от редактора: нет списка использованной литературы |
| Загрузить архив: | |
| Файл: ref-27117.zip (48kb [zip], Скачиваний: 181) скачать |
Муниципальное общеобразовательное учреждение
Курумоченская средняя общеобразовательная школа
Волжский район Самарская область
Аномалии воды.
Реферат выполнил
ученик 9 класса Г
Прокофьев Александр
Руководитель-
учитель химии высшей категории
МОУ Курумоченской СОШ
Карпова Марина Алексеевна
с. Курумоч
2006 год.
Содержание.
Введение.
Аномалии воды.
§1. Состав воды.
§2. Строение молекулы.
§3. Аномалии. Физические свойства.
§4. Химические свойства.
§5. Применение воды.
Заключение.
Список литературы.
Приложения.
Введение.
Вода дороже золота…
Антуан де Сент-Экзюпери.
Вода — это не только реки, моря, океаны, ледники, облака, дождь, снег. Ее находят в пустынях, которые называются безводными. Вода содержится в горных породах. Даже в расплавленной магме она присутствует в значительных количествах и выделяется в виде пара при извержении вулканов. Ни один процесс на Земле — гео- или техногенный — не проходит без участия воды. Да и сама жизнь на планете оказалась возможна только благодаря замечательным свойствам воды.
Данная тема реферата была выбрана потому, что вода мало изучается в школьном курсе. Она важна тем, что сейчас многих ставят в тупик мало или совсем не изученные свойства воды. Эта тема представляет очень большую научную ценность, так как вода, хоть и самое «изученное» вещество на Земле, но хранит в себе огромное количество тайн и загадок, порой необъяснимых.
Материалом для написания реферата послужили: журнал «Химия в школе» №7 за 2001 год; учебники по химии за 9 и 8 классы.
Целью данной работы является подробное теоретическое изучение аномалий воды. Для этого необходимо решить следующие задачи:
1. Изучение структуры, состава, химических и физических свойств воды.
2. Установление аномальности в свойствах воды.
3. Установление причин ее аномальности.
Чистая вода — бесцветная жидкость, без вкуса и запаха, кипит при 100°С (при давлении 101,3 кПа), замерзает при О °С, ее максимальная плотность (при 4 °С) равна 1 г/см3
На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
Некоторые аномалии в свойствах воды:
ØБлижайшие «родственники» воды - сероводород и селеноводород - газы, хотя их молекулярные массы в несколько раз превосходят массу молекул воды.
ØВоду трудно испарить. Ее удельная теплота испарения выше, чем у всех известных веществ.
ØТемпературы плавления и кипения воды гораздо выше, чем можно было бы ожидать исходя из закономерностей изменения этих параметров в ряду H2O—H2S—H2Se.
ØПоверхностное натяжение воды выше, чем у всех других жидкостей (кроме ртути).
§1.Состав воды.
При разложении воды электрическим током образуются газы: водород — два объема и кислород —
один объем. Зная, что
(0,089- 2): 1,429  1:8
1:8
Так как в молекуле воды не может быть меньше одного атома кислорода (16 а.е.м.), а простейшее массовое отношение водорода к кислороду равно 1:8, то в молекуле воды должно быть два атома водорода (2 а.е.м.). Следовательно, формула воды Н2О.
В таких же массовых отношениях водород и кислород реагируют при образовании воды. Для проведения этой реакции используют эвдиометр который представляет собой толстостенную трубку с делениями, закрытую резиновой пробкой с вставленными медными проволочками. Трубку заполняют дистиллированной водой и опускают открытым концом в сосуд. В эвдиометр вводят два объема кислорода и два объема водорода . Свободные концы проволочек соединяют проводами с индукционной катушкой, а последнюю — с источником электрического тока. Между сближенными концами проволочек проскакивает искра и происходит взрыв. Вода в трубке эвдиометра поднимается на три деления . Остается один объем газа, в котором тлеющая лучинка вспыхивает,— это кислород,
Следовательно, при образовании воды, так же как и при ее разложении, два объема водорода соединяются с одним объемом кислорода.
§2. Строение молекулы.
Как известно, свойства
химических соединений зависят от того, из каких элементов состоят их молекулы,
и изменяются закономерно. Воду можно рассматривать как оксид водорода или как
гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в
углах равнобедренного треугольника с длиной связи О – Н0,957 нм; валентный угол Н – О – Н104o
 |
 |
||
|
 |
 |
||
Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называетсяводородной. Она объединяет молекулы воды в своеобразные полимеры пространственного строения.
Тяжелая вода. В 1932 году американцы Г.Юри и Э.Осборн обнаружили, что даже в самой чистой воде, которую только можно получить в лабораторных условиях, содержится незначительное количество какого-то вещества, выражающегося, по-видимому, той же химической формулой Н2О, но обладающего молекулярным весом 20 вместо веса 18, присущего обычной воде. Юри назвал это вещество тяжёлой водой. Большой вес тяжёлой воды объясняется тем, что её молекулы состоят из атомов водорода с удвоенным атомным весом по сравнению с атомами обычного водорода. Двойной вес этих атомов в свою очередь обусловливается тем, что их ядра содержат, кроме единственного протона, составляющего ядро обычного водорода, ещё один нейтрон. Тяжёлый изотоп водорода получил название дейтерия (D или 2Н), а обычный водород стали называть протием. Тяжёлая вода, окись дейтерия, выражается формулойD2О.
Вскоребыл открыт третий, сверхтяжёлый изотоп водорода с одним протоном и двумя нейтронами в ядре, который был назван тритием (Т или 3Н). В соединении с кислородом тритий образует сверхтяжёлую воду Т2О с молекулярным весом 22.
В природных водах содержится в среднем около 0,016% тяжёлой воды. Тяжёлая вода внешне похожа на обычную воду, но по многим физическим свойствам отличается от неё. Точка кипения тяжёлой воды 101,40 С, точка замерзания + 3,80 С. Тяжёлая вода на 11% тяжелее обычной. Удельный вес тяжёлой воды при температуре 250 С равен1,1. Она хуже ( на 5 – 15% ) растворяет различные соли. В тяжёлой воде скорость протекания некоторых химических реакций иная, чем в обычной воде.
И в физиологическом отношении тяжёлая вода воздействует на живое вещество иначе: в отличие от обычной воды, обладающей живительной силой, тяжёлая вода совершенно инертна. Семена растений, еслиих поливать тяжёлой водой, не прорастают; головастики, микробы, черви, рыбы в тяжёлой воде не могут существовать; если животных поить одной тяжёлой водой, они погибнут от жажды. Тяжёлая вода – это мёртвая вода.
Омагниченная вода. Имеется ещё один вид воды, отличающийся по физическим свойствам от обычной воды, - это омагниченная вода. Такую воду получают с помощью магнитов, вмонтированных в трубопровод, по которому течет вода. Омагниченная вода изменяет свои физико-химические свойства: скорость химических реакций в ней увеличивается, ускоряется кристаллизация растворённых веществ, увеличивается слипание твёрдых частиц примесей и выпадение их в осадок с образованием крупных хлопьев (коагуляция). Омагничивание успешно применяется на водопроводных станцияхпри большой мутности забираемой воды. Она позволяет также быстро осаждать загрязненные промышленные стоки.
§3. Физические свойства. Аномалии воды.
Вода — это не только реки, моря, океаны, ледники, облака, дождь, снег. Ее находят в пустынях, которые называются безводными. Вода содержится в горных породах. Даже в расплавленной магме она присутствует в значительных количествах и выделяется в виде пара при извержении вулканов. Ни один процесс на Земле — гео- или техногенный — не проходит без участия воды. Да и сама жизнь на планете оказалась возможна только благодаря замечательным свойствам воды.
Чистая вода — бесцветная жидкость, без вкуса и запаха, кипит при 100°С (при давлении 101,3 кПа), замерзает при О °С, ее максимальная плотность (при 4 °С) равна 1 г/см3
На первый взгляд, вода кажется очень простым соединением, состоящим из атомов водорода и кислорода. На самом деле это самое аномальное вещество в мире.
В ряду однотипных водородных соединений элементов главной подгруппы VI группы H2S — H2Se— Н2Те температуры плавления и кипения с увеличением относительной молекулярной массы возрастают .
В соответствии с этой закономерностью вода должна замерзать около -100, кипеть около -80 0С
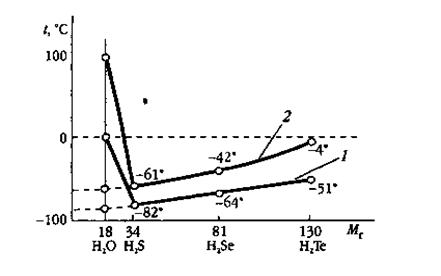
Зависимость температур плавления 1 и кипения 2 водородных соединений элементов главной подгруппы VI группы от молекулярной массы.
|
название |
теллуроводород |
селеноводород |
сероводород |
вода |
|
|
формула |
Н2Те |
Н2Sе |
Н2S |
Н2О |
|
|
t плавления |
- 510 С |
- 640 С |
- 820 С |
00 С |
|
|
t кипения |
- 40 С |
- 420 С |
- 610 С |
1000 С |
|
|
молекул. масса |
130 |
81 |
34 |
18 |
|
Два неспаренных электрона атома кислорода образуют две ковалентные полярные связи 0-Н, две электронные пары остаются неподеленными. Это приводит к некоторой асимметрии расположения гибридных орбиталей в пространстве. Электронная плотность связи ОН сильно смещена к более электроотрицательному атому кислорода, и ядро атома водорода (протон) почти лишается электронного облака. Обладая ничтожно малыми размерами, протон способен проникать в электронные оболочки электроотрицательных атомов соседних молекул. Такую связь называют водородной. Каждая молекула воды за счет двух электронных пар и двух атомов водорода образует четыре водородные связи. Энергия водородной связи в воде 25 кДж/моль. Прочность четырех водородных связей соизмерима с прочностью ковалентной связи. Все молекулы воды за счет водородных связей объединены в единый полимер. Ассоциация молекул, затрудняющая их отрыв друг от друга, и служит причиной аномально высоких температур плавления и кипения вод
Плотность льда меньше плотности воды, поэтому он не тонет. При плавлении льда разрушается лишь часть межмолекулярных связей, поэтому при температуре, близкой к 0 °С, жидкая вода содержит как остатки структуры льда, так и оторвавшиеся от них молекулы воды, которые размещаются в пустотах. Этим достигается более плотная упаковка молекул. Вследствие этого плотность воды в интервале от 0 до 4 °С повышается. При 4 °С плотность воды наибольшая.
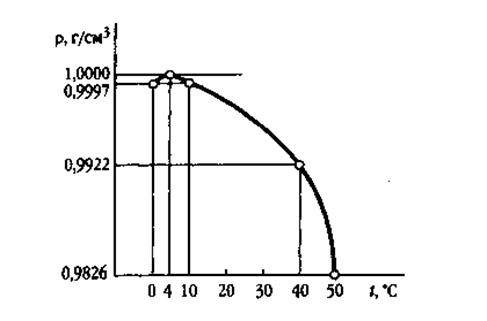
Зависимость плотности воды от температуры.
Расстояние между атомами кислорода соседних молекул льда равно 0,276 нм. С повышением температуры вследствие теплового движения молекул воды среднее расстояние между атомами кислорода увеличивается. При 15 °С оно достигает 0,290 нм, а при 83 °С — 0,305 нм. Плотность воды, соответственно, понижается.
Это свойство воды очень важно для существования жизни на Земле. Зимой намерзающий лед не тонет в воде. Полости придают льду высокие теплоизоляционные свойства. Подо льдом сохраняется постоянная температура. При охлаждении водоемов ниже 4 °С более холодная вода как менее плотная остается сверху и перемешивание слоев прекращается.
Имея структуру, сходную со строением кристаллической решетки алмаза, вода обладает свойствами твердых тел. Ничего странного нет в том, что полноводные реки промывают глубокие ущелья или широкие долины в крепчайших породах. Образовавшиеся за миллионы лет обширнейшие равнины на десятки километров в глубину состоят из осадочных пород — продукта работы древних рек.
При очень быстром ударе стальным бойком по тонкой струйке воды она рассыпается на осколки, подобно стеклянной или кварцевой палочке. Свойства воды как твердого тела широко используют в промышленности. Струя воды, вытекающая из небольшого отверстия с большой скоростью (давление в водяной камере свыше 1000 атм), режет камень или стальной лист.
Считается, что вода не сжимается. Однако на глубине
В отсутствие силы тяжести вода имеет форму шара, которую мы можем наблюдать при падении капель, а космонавты — в космическом корабле. Сферическая форма воды связана с поверхностным натяжением, которое обусловлено способностью молекул воды сцепляться (когезия). Это сцепление молекул вызвано водородными связями. Молекулы воды в поверхностном слое испытывают действие сил межмолекулярного притяжения только с одной стороны. Молекулы, находящиеся во внутренних слоях, стараются втянуть молекулы наружного слоя внутрь, и вследствие этого образуется упругая внешняя пленка, благодаря которой некоторые предметы (например, стальная иголка) могут лежать на поверхности воды, слегка ее прогибая. Многие насекомые (водомерки, многохвостки и др.) легко скользят по поверхности воды. Маленькие улитки — прудовики и катушки — ползают по внутренней стороне пленки, как по твердой поверхности, в поисках пищи. Поверхностное натяжение воды очень высокое — 0,073 Н/м при 20 °С. По прочности на разрыв струя воды не уступает стальной проволоке того же сечения.
Еще одно интересное свойство воды — способность смачивать поверхность твердого тела, «прилипать» к ней (адгезия). Если поверхность хорошо смачивается водой, например обезжиренное стекло, то вода растекается по ней сплошной пленкой, если не смачивается, то собирается каплями. С этим явлением связан капиллярный эффект -поднятие столбика воды вверх по очень узким трубочкам — капиллярам. Хорошо смачиваются вещества, с молекулами которых вода образует водородные связи. Это могут быть неорганические соединения с ионной и ковалентной полярной связью: кислоты, щелочи, соли, а также органические вещества, содержащие группы --ОН, -NH2, и т.д. Как правило, хорошо смачиваемые неорганические вещества в воде растворяются и распадаются на ионы — диссоциируют. Несмачиваемые вещества практически не растворяются.
Вода — весьма подвижная жидкость. Высокую текучесть воды можно объяснить
тем, что пустоты ее ажурной структуры заполнены отдельными молекулами, которые
легко встраиваются в вакансии кристаллической решетки, не нарушая водородных
связей, а также легко могут переходить из кристаллической решетки в пустоты
ажурной структуры. Кристаллические структуры воды и льда почти одинаковы. Силы
межмолекулярного притяжения в молекулярной решетке льда менее прочны, чем
ковалентные связи. При нагрузках на лед происходит его медленная деформация —
смещение слоев без разрушения кристаллической структуры. Поэтому лед тоже
течет. Ледники текут со скоростью
В то же время сотовая структура льда придаст ему высокую механическую прочность на сжатие. Изо льда строят надежные площадки.
В природе вода находится в трех фазовых состояниях: жидком,
газообразном (пар) и твердом (лед). Содержание пара в атмосфере определяют
давлением и температурой воздуха. За минуту солнце испаряет на Земле около
миллиарда тонн воды. Восходящими потоками воздуха вода поднимается в верхние
слои атмосферы, где, по расчетам, содержится 13 800 кмг парообразной воды. На
большой высоте при низких температуре и давлении водяной пар конденсируется и
превращается в мельчайшие капельки влаги облаков. Масса
При температуре О °С и давлении 1 атм. вода может одновременно находиться в трех фазах: твердой, жидкой и газообразной. В результате кристаллизации объем воды возрастает на 11 %. При замерзании в замкнутом пространстве увеличение объема приводит к избыточному давлению до 2500 атм. Внезапное выделение колоссальной энергии может быть причиной больших разрушений
Земная вода и поглощает, и возвращает очень много тепла, и тем самым “выравнивает” климат. Особенно заметно на формирование климата материков влияют морские течения, образующие в каждом океане замкнутые кольца циркуляции. Наиболее яркий пример – влияние Гольфстрима, мощной системы тёплых течений, идущих от полуострова Флорида в Северной Америке до Шпицбергена и Новой Земли. Благодаря Гольфстриму средняя температура января на побережье Северной Норвегии, за Полярным кругом, такая же, как в степной части Крыма, - около 00 С, т. е. повышена на15 – 200 С. А в Якутии на той же широте, но вдали от Гольфстрима – минус 400 С. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров. Водяной пар создаёт мощный “парниковый эффект”, который задерживает до 60% теплового излучения нашей планеты, не даёт ей охлаждаться. По расчётам М.И.Будыко, при уменьшении содержания водяного пара в атмосфере вдвое средняя температура поверхности Земли понизилась бы более чем на 50 С (с 14,3 до 90 С). На смягчение земного климата, в частности на выравнивание температуры воздуха в переходные сезоны – весну и осень, заметное влияние оказывают огромные величины скрытой теплоты плавления и испарения воды.
Вода – это важный источник энергоресурсов. Как известно, все гидроэлектрические станции мира, от маленьких до самых крупных, превращают механическую энергию водного потока в электрическую исключительно с помощью водяных турбин с соединёнными с ними электрогенераторами. На атомных электростанцияхатомный реактор нагревает воду, водяной пар вращает турбину с генератором и вырабатывает электрический ток.
§4. Химические свойства.
Особенно важны способность её молекул диссоциировать (распадаться) на ионы и способность воды растворять вещества разной химической природы.
Роль воды как главного и универсального растворителя определяется прежде всего полярностью её молекул и, как следствие, её чрезвычайно высокой диэлектрической проницаемостью. Разноимённые электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погружённого в воду тела также слабее, чем в воздухе. Тепловому движению в этом случае легче разбить молекулы. Оттого и происходит растворение, в том числе многих труднорастворимых веществ: капля камень точит.
Лишь незначительная доля молекул (одна из 500,000,000) подвергается электролитической диссоциации по схеме:
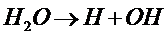
Однако, приведённое уравнение условное: не может существовать в водной среде лишённый электронной оболочки протон Н+. Он сразу соединяется с молекулой воды, образуя ион гидроксония Н3О+, который в свою очередь объединяется с одной, двумя или тремя молекулами воды в Н3О+ , Н5О2+ , Н7О3+
Электролитическая диссоциация воды – причина гидролиза солей слабых кислот и(или) оснований. Степень электролитической диссоциации заметно возрастает при повышении температуры.
Образование воды из элементов по реакции:
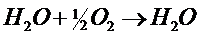 - 242 кДж/моль
для пара
- 242 кДж/моль
для пара
- 286 кДж/моль для жидкой воды
-при низких температурах в отсутствии катализаторов происходит крайне медленно, но скорость реакции резко возрастает при повышении температуры, и при 5500 С она происходит со взрывом. При понижении давления и повышении температуры равновесие сдвигается влево.
Вода – реакционноспособное соединение.
Вода окисляется атомарным кислородом:
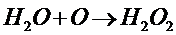
При взаимодействии с F2образуется НF, а также О2 ;О3 ; Н2О2 ; F2О и другие соединения.
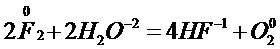
С остальными галогенами при низких температурах вода реагирует с образованием смеси кислот Н Г и Н Г О.
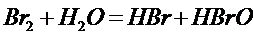
При обычных условиях с водой взаимодействует до половины растворённого в нейСl2и значительно меньшие количестваBr2и J2.
При повышенных температурахСI2 и Br2разлагают воду с образованиемН ГалиО2.
При пропускании паров воды через раскалённый уголь она разлагается и образуется так называемый водяной газ:

При повышенной температуре в присутствии катализатора вода реагирует с СО; СН4и другими углеводородами, например:
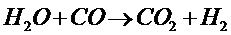
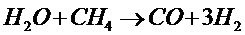
Эти реакции используют для промышленного получения водорода.
Фосфор при нагревании с водой под давлениемв присутствии катализатора окисляется в метафосфорную кислоту:
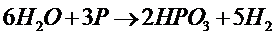
Вода взаимодействует со многими металлами с образованиемН2и соответствующего гидроксида.
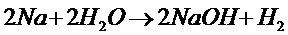
Со щелочными и щелочно-земельными металлами (кроме Мg ) эта реакция протекает уже при комнатной температуре. Менее активные металлы разлагают водупри повышенной температуре, например, Мgи Zn – выше 1000 С;Fe – выше6000 С:
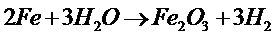
При взаимодействии с водой многих оксидов образуются кислоты или основания.

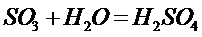
Вода может служить катализатором, например, щелочные металлы и водород реагируют с CI2только в присутствии следов воды.
Иногда вода – каталитический яд, например, для железного катализатора при синтезеNH3.
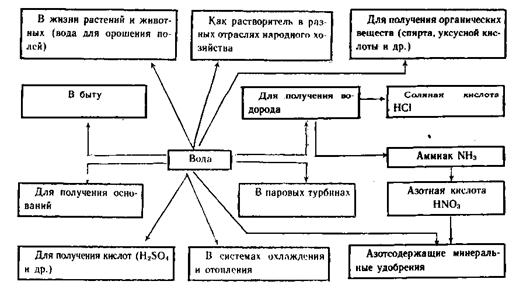
§5. Применение воды.
Роль воды в промышленности, в сельском хозяйстве и в быту очень велика и многообразна. Вода является важным сырьем для химической промышленности, например для получения водорода. Способность воды реагировать с некоторыми оксидами используется для получения оснований и кислот. Вода широко применяется как растворитель. Даже если речь пойдет только о промышленности, то области применения воды настолько обширны, что практически невозможно назвать какой-либо производственный процесс, в котором не использовалась бы вода. Промышленность нашей страны ежесекундно потребляет столько воды, сколько несет ее Волга. На получение 1 т стали расходуется 150 т воды, бумаги - 250 т, синтетических волокон ~ 4000 т.
Вода используется в сельском хозяйстве для полива, например, овощных, зеленных и технических культур, а также при производстве сельскохозяйственной продукции.
Многие химические процессы ускоряются в присутствии воды, т. е. вода играет роль катализатора. А, например, при получении кислот, гашении
извести, в процессах гидратации, схватывания и затвердевания связывающих материалов (цемент, гипс, известь) вода - активный реагент.Как это ни странно звучит, но вода играет определенную роль и в искусстве: каскады прудов и фонтаны украшают сады и парки. Во многих странах есть традиция сооружать зимой ледяные скульптуры героев сказок и легенд. Области использования воды показаны на схеме.
|
|
Заключение.
Вода—самое изученное вещество на Земле. Но это не совсем так. Например, недавно ученые обнаружили, что вода способна нести информацию, которая стирается, если воду сначала заморозить, а затем разморозить. Также, ученые не могут объяснить тот факт, что вода способна воспринимать музыку. Например, при прослушивании Чайковского, Моцарта, Баха и последующей заморозке образуются кристаллы правильной формы, а после тяжелого рока нечто бесформенное. То же самое наблюдается присравнении матери Терезы и Гитлера; слов «любовь», «надежда» ислова «дурак». Кроме того, ученые сравнивали и энергетику воды, и оказалось, что вода со столовых гор Африки заряжена намного сильнее, чем вода из крана, а вода в огромных бутылках, какая бы она не была чистая, мертва. Еще, как бы то ни было парадоксально, без воды невозможно горение! Ведь вода содержится везде и очень многое из этого горит. Если из бензина удалить всю воду, то он абсолютно перестанет гореть. И даже сама вода горит!!! Правда не так интенсивно, но все же факт остаётся фактом.
Многим известно, что вода способна образовывать очень устойчивое соединение с нефтью, которое не годится для переработки. Но российские ученые придумали способ их разделения. Для этого на нефтяной субстрат воздействовали электромагнитным полем в течение недели. И по ее истечении он разделился на нефть и воду. Но самое интересное то, что частота поля была равна частоте биотоков сердца.
Гидросфера — водная оболочка Земли: 3/4 поверхности планеты покрыты водой Общий объем водных запасов 1 400 000 000 км3, из них:
97 % — соленая вода Мирового океана;
2,2 % — ледники покровные и горные и плавающие льды;
Детальные геологические замеры показали, что за 80-100 млн. лет вся земная суша сносится водным стоком в Мировой океан. Движущая сила этого процесса — круговорот воды в природе — один из главных планетарных процессов.
Под действием солнечной энергии Мировой океан испаряет около 1 млрд. тонн воды в минуту. Поднимаясь в верхние холодные слои атмосферы, водяной пар конденсируется в микрокапли, которые постепенно укрупняются и образуют облака. Средний срок жизни облака 8-9 дней. За это время ветер может переместить его на 5-10 тыс. км, поэтому значительная часть облаков оказывается над сушей. Дальнейшее укрупнение микрокапель превращает облака в тучи, из которых выпадают осадки. Большая часть осадков (80 %) попадает в Мировой океан, меньшая (20 %) — на сушу.
Вода-это наше прошлое, это наше настоящее и это наше будущее. Вода-это наше все. Но, к сожалению люди зачастую забывают об этом. И результатом этого является загрязнение воды, но люди не задумываются о том, что и сами они состоят из воды на 80-90% . И может быть вода несет в себе информацию об этом и когда-нибудь она нам отомстит.
В ходе работы над проектом я решил следующие задачи:
1. Изучил структуру, состав, химические и физические свойства воды.
2. Установил аномальности в свойствах воды.
3. Установил причины ее аномальности.
И благодаря этому достиг своей цели - т.е. более подробно изучил аномалии воды.