Пищеварение
| Загрузить архив: | |
| Файл: ref-27118.zip (34kb [zip], Скачиваний: 99) скачать |
Вступление.
Обычно, с процессом пищеварения мы сталкиваемся трижды в день. Немногие задумываются, что же происходит во время этого процесса.
В данном проекте будут подробно рассмотрены преобразования, происходящие с пищей в процессе пищеварения. Для этого необходимо решить следующие задачи:
1.собрать информацию о процессе пищеварения;
2.установление роли ферментов;
3.проверка выводов экспериментально.
Данная тема была выбрана по нескольким причинам:
ØПроверить достоверность учебного материала на практике;
ØУзнать подробнее о ферментах;
ØПолучить больше знаний о процессе пищеварения.
Основными источниками для написания проекта послужили:
ØЭнциклопедия Кирилла и Мефодия;
ØЭнциклопедия Брокгауза и Ефрона и т.д.
Содержание.
I.Вступление 3
II.Пищеварение................................................................................... 4
1.Пищеварение в ротовой полости....................................... 4
1.1 Слюна........................................................................... 4 ......................................................................................
2.Пищеварение в желудке..................................................... 6
2.1 Ферменты...................................................................... 7
3.Пищеварение в кишечнике................................................. 12
III. Свойства ферментов ...................................................................... 14
1.Оксидазы и пероксидазы.................................................... 14
2.Дегидрогеназы.................................................................... 16
3.Амилазы.............................................................................. 17
4.Каталаза.............................................................................. 18
IV. Заключение...................................................................................... 19
V. Список используемой литературы.................................................. 20
1. Пищеварение в ротовой полости
В ротовой полости начинается первичная механическая, и химическая обработка пищи: размельчение при жевании, смачивание слюной и формирование ее в пищевой комок, который затем в результате глотания поступает в пищевод и далее — в желудок. Слюна, секретируемая слюнными железами, представляет собой слабощелочную жидкость, содержащую ферменты, неорганические соли, белок и муцин. Пищеварение в ротовой полости связано, главным образом, с расщеплением углеводов. Фермент амилаза гидролизует крахмал до мальтозы, которую затем мальтаза превращает в глюкозу. В незначительных количествах в слюне содержатся и протеолитические ферменты, расщепляющие белки. Переваривание углеводов под влиянием ферментов слюны продолжается внутри пищевого комка и в желудке, до тех пор, пока соляная кислота желудочного сока не дезактивирует эти ферменты.
1.1Слюна
Слюна-первая жидкость, с которой встречаются пищевые вещества при поступлении в полость рта; эта жидкость смешанная, составленная из выделений трех пар слюнных желез — околоушной, подчелюстной и подъязычной и слизистых желез полости рта. Главными органическими составными частями являются муцин, немного белка и специальный фермент — птиалин, превращающий крахмал в глюкозу. Среди солей, обычных для лимфы и крови, встречается также и роданистый калий. Специальные составные части слюна вырабатываются слюноотделительными клетками слюнных желез, и слюна представляет их настоящий секрет, или отделение. У человека же и некоторых животных она, благодаря птиалину, т. е. амилалитическому ферменту, превращает еще крахмал пищи сперва в декстрин, а затем и в виноградный сахар.
Птиалин, подобно остальным ферментам, совершает это превращение, участвуя в процессе в самых малых дозах и почти не затрачиваясь на эту химическую работу. Обстоятельство это имеет огромное значение в экономии организма, сберегая его силы на фабрикацию деятельных пищеварительных веществ; являясь в виде ферментов, эти переваривающие вещества приготовляются отделительными клетками в самых ничтожных количествах. Об общих свойствах ферментов — организованных и неорганизованных. Муцин, слепляя частицы разжеванной пищи, способствует образованию подлежащего проглатыванию пищевого кома и, смазывая его снаружи, придает ему скользкость, необходимую для легкого проглатывания и передвижения по глотке и пищеводу. Изучение в отдельности секретов различных слюнных желез путем собирания их через постоянные или временные фистулы показало, что у человека, способностью превращать крахмал в сахар обладает слюна околоушных и подчелюстных желез, но последние оказываются в этом отношении более деятельными. Птиалин с первого же дня жизни находится только в отделении околоушной железы; в соке же подчелюстной железы он появляется на третьем месяце после рождения. Эти факты рядом с тем, что и в панкреатической железе в первые месяцы жизни фермент, превращающий крахмал в сахар, почти совершенно отсутствует, ясно указывают, почему питание младенцев мучнистыми, крахмалистыми веществами является нецелесообразным и вредным. Кроме того, доказано, что при поражении у младенцев полости рта плесневым грибком, известном под названием молочницы, слюна их утрачивает совершенно способность превращать крахмал в сахар. Что касается самого процесса отделения слюны у развитых животных и человека, то он находится под ближайшим заведованием нервной системы. Опыт будничной жизни уже указывает, что слюноотделение находится в ближайшем соотношении с миром психических явлений: с представлениями и душевными движениями. У голодного человека представление о вкусном блюде заставляет течь слюну; вид сена или мяса вызывают у голодной лошади и собаки сильное слюнотечение. Зато, с другой стороны, чувство страха, беспокойства, задерживая слюноотделение, заставляют высыхать рот; вот причина, почему публичные чтецы, ораторы, экзаменующиеся так часто прибегают к стакану воды.
2.Пищеварение в желудке
Желудок играет роль резервуара, где пищевые массы перемешиваются с желудочным соком. Пищевые массы, смешанные с желудочным соком, называются химусом. Хорошо развитая система гладкомышечных элементов желудка и кишечника, обусловливающая разнообразные формы его моторики, в том числе и перистальтику, способствует как продолжению механической обработки пищи, так и ее транспорту. В желудке по мере действия пищеварительного сока начинается расщепление белков до пептонов. Основным ферментом, гидролизующим белки в желудке, является пепсин, который образуется из предшественника — пепсиногена, секретируемого главными клетками фундальных желез. Превращение пепсиногена в пепсин происходит под влиянием соляной кислоты, секретируемой париетальными клетками фундальных желез. Оптимум протеолитической активности пепсина находится при рН 1,5-2. Соляной кислоте принадлежит значительная роль в желудочном пищеварении, так как она не только активирует ферменты, но и способствует перевариванию белков, вызывая их набухание и разрыхление. В желудочном соке находится также химозин, или сычужный фермент, створаживающий молоко в присутствии солей кальция. Фермент, гидролизующий жиры, — липаза — играет небольшую роль в желудочном пищеварении, т. к. он способен расщеплять только эмульгированный жир молока. В желудке пища в зависимости от ее состава и количества находится 4-10 часов, причем плохо пережеванная пища задерживается в желудке дольше, чем жидкая или кашицеобразная. Быстрее всего из желудка удаляются углеводы, несколько медленнее — белки. В последнюю очередь происходит эвакуация жирной пищи. Скорость опорожнения желудка зависит также и от скорости гидролиза пищи и поступления в двенадцатиперстную кишку жиров и соляной кислоты.
2.1 Ферменты.
Так как реакции обмена веществ, протекающие в организмах, можно разделить на два типа процессов: синтеза (анаболические) и распада (катаболические), то соответственно можно выделить и два типа ферментов. Примером анаболического фермента может служить глутаминсинтетаза:
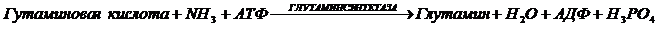 Примером катаболического фермента
может служить мальтаза:
Примером катаболического фермента
может служить мальтаза:
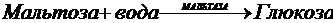
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов.
Размер молекул. Понятно, что, будучи по своей природе белками, ферменты должны иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц. Это не позволяет отнести их ни к гомогенным, ни к гетерогенным катализаторам. Остается отнести их к особому классу катализаторов.
Селективность. Каждый фермент ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту их особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить четкую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов-мономеров (аминокислот, глицерина и жирных кислот, моносахаридов соответственно) и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма.
Эффективность. Большинство ферментов обладает очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз больше скорости реакций, протекающих в их отсутствие. Такая высокая эффективность ферментов объясняется тем, что их молекулы в процессе «работы» очень быстро восстанавливаются (регенерируют).
Типичная молекула фермента может регенерировать миллионы раз за минуту, например, широко используемый в сыроделии фермент реннин способен вызывать коагуляцию (свертывание) белков молока в количествах, в миллионы раз превышающих его собственную массу. Этот фермент вырабатывается слизистой оболочкой особого отдела желудка жвачных животных — сычуга.
А вот еще один пример высокой эффективности «работы» фермента,— каталазы. За одну секунду при температуре, близкой к точке замерзания воды, одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода:

Этот катализатор снижает энергию активации от 75 кДж/моль до 21 кДж/моль. Для сравнения укажем, что если для ускорения этой реакции применяется платина, находящаяся в коллоидном состоянии, то энергия активации понижается только до 50 кДж/моль. Что же такое энергия активации. Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Вот такая энергия, которая необходима для того, чтобы вещества начали взаимодействовать между собой, и называется энергией активации. Чем больше требуемая энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция. Они повышают общую скорость реакции, не изменяя в какой-нибудь значительной степени температуру, при которой эта реакция протекает. Аналогично «работают» и неорганические катализаторы, но они уступают в эффективности ферментам.
Зависимость от температуры. Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела. Человек погибает при более низких и более высоких температурах не столько из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают действовать ферменты а, следовательно, прекращаются обменные процессы, которые и определяют сам процесс жизни. Неорганические катализаторы сохраняют активность в более широком интервале температур. Вспомните, например, синтез аммиака, который проводят при температуре 450—500 °С (катализатор — железо).
Зависимость от среды раствора. Ферменты наиболее эффективно действуют на субстрат при строго определенной среде раствора, при определенных значениях так называемого рН. Величина рН, как показано на схеме, характеризует кислотность и основность растворов и может принимать значения от 1 до 14.
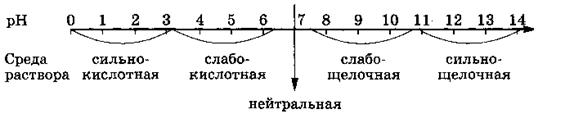
Фермент желудочного сока пепсин наиболее активен при рН 1,5—2 (сильнокислая среда), каталаза крови — при рН 7 (нейтральная среда) и т. д.
Кислотность или основность среды физиологических жидкостей определяет биологическую активность клеток организма, которая, в свою очередь, определяется «работой» действующих в них ферментов (табл. 1). Каждая из физиологических жидкостей имеет определенное значение рН, и отклонение от нормы может быть причиной тяжелых заболеваний.
Таблица 1. Значения рН физиологических жидкостей
|
Среда |
Значение рН |
Возможные отклонения |
|
Желудочный сок Желчь печеночная Слюна Сок верхнего отдела толстого кишечника Сок поджелудочной железы Сок толстого кишечника |
1,7 7,4 6,8 6,1 8,8 6,5 |
0,9-2,0 6,2-8,5 5,6-7,9 - 8,6-9,0 5,1-7,1 |
В контакт с субстратом вступает лишь очень небольшая часть молекулы фермента, так называемый активный центр Он включает обычно от 3 до 15 аминокислотных остатков полипептидной молекулы фермента. Высокая специфичность фермента обусловлена особой формой его активного центра, которая точно соответствует форме молекулы вещества катализируемой реакции. Их можно сравнить с «ключом и замком»: катализируемое вещество выступает в роли «ключа», который точно подходит к «замку», т. е. к ферменту.
Многие ферменты для проявления активности нуждаются в веществах небелковой природы — так называемых кофакторах. В роли последних могут выступать ионы металлов (цинка, марганца, кальция и др.) или молекулы органических соединений; в последнем случае их называют коферментами, Иногда для действия фермента бывает необходимо присутствие, как ионов металла, так и коферментов.
В некоторых случаях кофермент очень прочно соединен е белком, например у каталазы, где кофермент представляет собой комплексное соединение железа с белком — гемоглобин.
В других ферментах коферменты представляют собой вещества, близкие к витаминам, которые являются предшественниками коферментов. Например, из витамина В1 (тиамина) в клетках образуется тиаминпирофосфат — кофермент важного фермента, входящего в группу декарбоксилаз; из витамина В12 образуются коферменты, необходимые для усвоения жирных кислот с нечетным числом атомов углерода.
Классификация. В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Согласно этой номенклатуре ферменты были поделены на шесть групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент при этом получил систематическое название, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было также присвоено и тривиальное, рабочее название, предназначенное для повседневного употребления. В большинстве случаев оно состоит из названия вещества, на которое действует фермент, указания на тип катализируемой реакции и окончания - аза (табл. 2),
Таблица 2. Классификация ферментов
|
Классы ферментов |
Катализируемая реакция |
Примеры ферментов или их групп |
|
Оксидоре- дуктазы |
Перенос атомов водорода или электронов от одного вещества к другому |
Дегидрогеназа, оксидаза |
|
Трансфе- разы |
Перенос определенной группы атомов- метильной, ацильной, фосфатной или аминогруппы - от одного вещества к другому |
Трансаминаза, киназа |
|
Гидро- лазы |
Реакции гидролиза |
Липаза, амилаза |
|
Лиазы |
Негидролитическое присоединение к субстрату или отщепление от него Группы атомов. При этом могут разрыватьсясвязи C-C,C-N,C-O или C-S, |
Декарбоксилаза, Фумараза, альдолаза |
|
Изоме- разы |
Внутримолекулярная перестройка |
Изомераза, мутаза |
|
Лигазы |
Соединение двух молекул в результате образования новых связей C-C,C-N,C-O или C-S, сопряженное с распадом АТФ |
Синтетаза |
Значение ферментов невозможно переоценить. Только в человеческом организме ежесекундно происходят тысячи и тысячи ферментативных химических реакций. Например, фермент амилаза, который содержится в слюне (его еще называют птиалином) и в соке тонкого кишечника, помогает превращению крахмала в мальтозу. Затем мальтоза превращается в глюкозу в тонком кишечнике с помощью другого фермента — малътазы. В желудке и тонком кишечнике такие ферменты, как пепсин и трипсин, превращают белки в более простые соединения — пептиды. Затем эти пептиды превращаются в тонком кишечнике в аминокислоты под действием ферментов, которые, понятно, называются пептидазами. А вот на жиры (липиды) в тонком кишечнике действует фермент липаза, расщепляющий их до глицерина и жирных кислот.
3. Пищеварение в кишечнике
Из желудка кислый химус небольшими порциями поступает в верхний отдел кишечника — двенадцатиперстную кишку. В тонком кишечнике он перемешивается с щелочными секретами поджелудочной железы, печени и кишечных желез. Переваривание пищи в двенадцатиперстной кишке осуществляется главным образом за счет ферментов панкреатического сока при участии желчи. Протеолитические ферменты поджелудочной железы (трипсин, химотрипсин и эластаза) синтезируются в виде неактивных предшественников. Их активация происходит в нейтральной или слабощелочной среде под влиянием энтерокиназы — эндопептидазы, секретируемой слизистой двенадцатиперстной кишки. Кроме протеаз, в панкреатическом соке присутствуют ферменты, расщепляющие жиры (панкреатическая липаза, фосфолипаза А и лецитиназа), углеводы (панкреатическая альфа-амилаза) и нуклеиновые кислоты (нуклеазы).
Желчь, вырабатываемая печенью и хранящаяся в желчном пузыре, во время пищеварения поступает в двенадцатиперстную кишку. Ее главное значение — активация ряда ферментов поджелудочного и кишечного соков, особенно липазы, которая в присутствии желчи действует в 15-20 раз сильнее. Понижая поверхностное натяжение, желчь эмульгирует жиры, что увеличивает поверхность их взаимодействия с ферментами.
Кишечный сок, выделяемый железами слизистой оболочки на всем протяжении тонкого кишечника, содержит многочисленные ферменты (аминопептидазу, дипептидазу, мальтазу, лактазу, фосфолипазу и др.), обеспечивающие конечные этапы переваривания белков, жиров и углеводов. В тонком кишечнике происходит переваривание 80% углеводов и почти 100% белков и жиров, причем главным образом за счет мембранного пищеварения, эффективность которого определяется тем, что пищеварительные ферментные системы расположены в непосредственной близости от встроенных в мембрану транспортных систем, обеспечивающих всасывание конечных продуктов гидролиза.
Так как реакции обмена веществ, протекающие в организмах, можно разделить на два типа процессов: синтеза (анаболические) и распада (катаболические), то соответственно можно выделить и два типа ферментов. Примером анаболического фермента может служить глутаминсинтетаза:
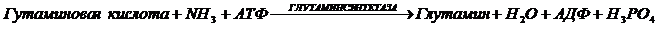 Примером катаболического фермента
может служить мальтаза:
Примером катаболического фермента
может служить мальтаза:
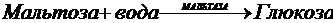
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов.
Размер молекул. Понятно, что, будучи по своей природе белками, ферменты должны иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц. Это не позволяет отнести их ни к гомогенным, ни к гетерогенным катализаторам. Остается отнести их к особому классу катализаторов.
Селективность. Каждый фермент ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту их особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить четкую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов-мономеров (аминокислот, глицерина и жирных кислот, моносахаридов соответственно) и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма.
Эффективность. Большинство ферментов обладает очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз больше скорости реакций, протекающих в их отсутствие. Такая высокая эффективность ферментов объясняется тем, что их молекулы в процессе «работы» очень быстро восстанавливаются (регенерируют).
Типичная молекула фермента может регенерировать миллионы раз за минуту, например, широко используемый в сыроделии фермент реннин способен вызывать коагуляцию (свертывание) белков молока в количествах, в миллионы раз превышающих его собственную массу. Этот фермент вырабатывается слизистой оболочкой особого отдела желудка жвачных животных — сычуга.
А вот еще один пример высокой эффективности «работы» фермента,— каталазы. За одну секунду при температуре, близкой к точке замерзания воды, одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода:

Этот катализатор снижает энергию активации от 75 кДж/моль до 21 кДж/моль. Для сравнения укажем, что если для ускорения этой реакции применяется платина, находящаяся в коллоидном состоянии, то энергия активации понижается только до 50 кДж/моль. Что же такое энергия активации Представим себе смесь бензина и кислорода. Реакция между этими двумя веществами возможна, но она не пойдет без затраты некоторого количества энергии, поступившей, например, в форме простой искры. Вот такая энергия, которая необходима для того, чтобы вещества начали взаимодействовать между собой, и называется энергией активации. Чем больше требуемая энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция. Они повышают общую скорость реакции, не изменяя в какой-нибудь значительной степени температуру, при которой эта реакция протекает. Аналогично «работают» и неорганические катализаторы, но они уступают в эффективности ферментам.
Зависимость от температуры. Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т. е. приблизительно при 37 °С. Человек погибает при более низких и более высоких температурах не столько из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают действовать ферменты, а следовательно, прекращаются обменные процессы, которые и определяют сам процесс жизни. Неорганические катализаторы сохраняют активность в более широком интервале температур. Вспомните, например, синтез аммиака, который проводят при температуре 450—500 °С (катализатор — железо).
Зависимость от среды раствора. Ферменты наиболее эффективно действуют на субстрат при строго определенной среде раствора, при определенных значениях так называемого рН. Величина рН, как показано на схеме, характеризует кислотность и основность растворов и может принимать значения от 1 до 14.
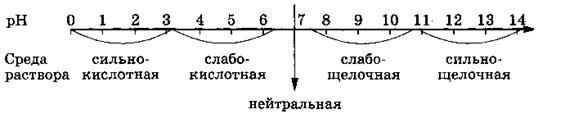
Фермент желудочного сока пепсин наиболее активен при рН 1,5—2 (сильнокислая среда), каталаза крови — при рН 7 (нейтральная среда) и т. д.
Кислотность или основность среды физиологических жидкостей определяет биологическую активность клеток организма, которая, в свою очередь, определяется «работой» действующих в них ферментов (табл. 1). Каждая из физиологических жидкостей имеет определенное значение рН, и отклонение от нормы может быть причиной тяжелых заболеваний.
Таблица 1. Значения рН физиологических жидкостей
|
Среда |
Значение рН |
Возможные отклонения |
|
Желудочный сок Желчь печеночная Слюна Сок верхнего отдела толстого кишечника Сок поджелудочной железы Сок толстого кишечника |
1,7 7,4 6,8 6,1 8,8 6,5 |
0,9-2,0 6,2-8,5 5,6-7,9 - 8,6-9,0 5,1-7,1 |
В контакт с субстратом вступает лишь очень небольшая часть молекулы фермента, так называемый активный центр Он включает обычно от 3 до 15 аминокислотных остатков полипептидной молекулы фермента. Высокая специфичность фермента обусловлена особой формой его активного центру которая точно соответствует форме молекулы вещества катализируемой реакции. Их можно сравнить с «ключом и замком»: катализируемое вещество выступает в роли «ключа», который точно подходит к «замку», т. е. к ферменту.
Многие ферменты для проявления активности нуждаются в веществах небелковой природы — так называемых кофакторах. В роли последних могут выступать ионы металлов (цинка, марганца, кальция и др.) или молекулы органических соединений; в последнем случае их называют коферментами, Иногда для действия фермента бывает необходимо присутствие, как ионов металла, так и коферментов.
В некоторых случаях кофермент очень прочно соединен е белком, например у каталазы, где кофермент представляет собой комплексное соединение железа с белком — гемоглобин.
В других ферментах коферменты представляют собой вещества, близкие к витаминам, которые являются предшественниками коферментов. Например, из витамина В1 (тиамина) в клетках образуется тиаминпирофосфат — кофермент важного фермента, входящего в группу декарбоксилаз; из витамина В12 образуются коферменты, необходимые для усвоения жирных кислот с нечетным числом атомов углерода.
Классификация.
В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая номенклатура ферментов. Согласно этой номенклатуре ферменты были поделены на шесть групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент при этом получил систематическое название, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было также присвоено и тривиальное, рабочее название, предназначенное для повседневного употребления. В большинстве случаев оно состоит из названия вещества, на которое действует фермент, указания на тип катализируемой реакции и окончания - аза (табл. 2),
Таблица 2. Классификация ферментов
|
Классы ферментов |
Катализируемая реакция |
Примеры ферментов или их групп |
|
Оксидоре- дуктазы |
Перенос атомов водорода или электронов от одного вещества к другому |
Дегидрогеназа, оксидаза |
|
Трансфе- разы |
Перенос определенной группы атомов- - метильной, ацильной, фосфатной или аминогруппы - от одного вещества к другому |
Трансаминаза, киназа |
|
Гидро- лазы |
Реакции гидролиза |
Липаза, амилаза |
|
Лиазы |
Негидролитическое присоединение к Субстрату или отщепление от него Группы атомов. При этом могут разрываться связи C-C,C-N,C-O или C-S, |
Декарбоксилаза, Фумараза, альдолаза |
|
Изоме- разы |
Внутримолекулярная перестройка |
Изомераза, мутаза |
|
Лигазы |
Соединение двух молекул в результате образования новых связей C-C,C-N, C-O или C-S, сопряженное с распадом АТФ |
Синтетаза |
Значение ферментов невозможно переоценить. Только в человеческом организме ежесекундно происходят тысячи и тысячи ферментативных химических реакций. Например, фермент амилаза, который содержится в слюне (его еще называют птиалином) и в соке тонкого кишечника, помогает превращению крахмала в мальтозу. Затем мальтоза превращается в глюкозу в тонком кишечнике с помощью другого фермента — малътазы. В желудке и тонком кишечнике такие ферменты, как пепсин и трипсин, превращают белки в более простые соединения — пептиды. Затем эти пептиды превращаются в тонком кишечнике в аминокислоты под действием ферментов, которые, понятно, называются пептидазами. А вот на жиры (липиды) в тонком кишечнике действует фермент липаза, расщепляющий их до глицерина и жирных кислот.
Итак, мы рассмотрели процесс пищеварения с химической и биологическойстороны. В проекте были решены следующие задачи:
1.собрали информацию о процессе пищеварения;
2.установили роль ферментов;
3.проверили выводы экспериментально.
И благодаря этому достиг, свей цели — изучил процесс пищеварения.
Пищеварение — самый распространенный процесс на Земле. Вряд ли в мире есть организм, который без него обходится. Если рассматривать его как процесс получения энергии, то это расширяет границы этого понятия, ведь энергия—это то, что дает нам возможность жить. В данном проекте, конечно этот аспект не рассматривался, но главные процессы происходят в клетке, где и происходит синтез энергии и её использование.
На мой взгляд, данное пособие можно использовать как учебный материал.