Можно ли обойти равновесие?
| Примечание | Что не запрещено, то разрешено. Так что же запрещено в ходе химических реакций, теплопереноса и других диссипативных процессов? Можно ли «перебросить» систему через равновесие, и если да, то на какую величину? |
| Загрузить архив: | |
| Файл: ref-27916.zip (920kb [zip], Скачиваний: 62) скачать |
Можно ли обойти равновесие?
А.Н. Горбань ag153@le.ac.uk, Г.С. Яблонский gy@seas.wustl.edu
Что не запрещено, то разрешено. Так что же запрещено в ходе химических реакций, теплопереноса и других диссипативных процессов? Можно ли «перебросить» систему через равновесие, и если да, то на какую величину? На примере эффектов обхода равновесия обсуждаются термодинамически разрешенные и запрещенные пути процессов.
Is It Possible to Circumvent Equilibrium?
A.N. Gorban ag153@le.ac.uk, G.S. Yablonskii gy@seas.wustl.edu
Everything that is not prohibited is permissible. So, what is prohibited in the course of chemical reactions, heat transfer and other dissipative processes? Is it possible to “overshoot” the equilibrium, and if yes, then how far? Thermodynamically allowed and prohibited trajectories of processes are discussed by the example of effects of equilibrium encircling.
ОГЛАВЛЕНИЕ
TOC o "1-3" h z u Введение. PAGEREF _Toc183187272 h 2
1. Теплообмен. PAGEREF _Toc183187273 h 2
2. Закон действия масс. PAGEREF _Toc183187274 h 8
3. Изомеризация. PAGEREF _Toc183187275 h 10
Термодинамические ограничения. PAGEREF _Toc183187276 h 10
Ограничения, связанные с механизмом реакции. PAGEREF _Toc183187277 h 14
Заключение. PAGEREF _Toc183187278 h 18
Литература. PAGEREF _Toc183187279 h 19
Введение
В начале было A, вещество A, 100% A в закрытом сосуде. Потом из A начало образовываться B. Появившись, B превращается обратно в A. Условия постоянны, скорости превращений пропорциональны концентрациям. Система стремится к равновесию. Пусть для определенности в равновесии концентрации Aи Bравны. Вопрос: может ли где-то по дороге к равновесию количество B в системе стать больше 50%? Ответ очевиден - нет. Если концентрации Aи B дойдут до 50% процентов, то изменения прекратятся - это равновесие. Система одномерна - одна координата (например, концентрация A) полностью описывает состояние при фиксированных условиях - заданной температуре и известном объеме. На прямой обойти равновесие невозможно.
А если в системе есть еще вещество C? Что тогда - можно ли
обойти равновесие? Это первый вопрос. Ответ на него - «да». Поэтому возникает
второй: насколько сильно можно обойти равновесие в данном случае? Пусть (опять
же для определенности) равновесные концентрации A, B, и
С равны друг другу и все эти вещества
могут превращаться друг в друга (являются изомерами). Если нет специальных
ограничений на механизм превращений, то для этой системы обход равновесия
возможен и если в начальный момент в системе 100% A, то по дороге к равновесию
концентрация B не превышает верхней
границы 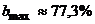
1. Теплообмен
Яркие примеры обхода равновесия можно получить, рассматривая следующую задачу.
Задача. Два тела одинаковой
теплоемкости имеют различную температуру: 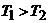 (первое - горячее,
второе - холодное). Можно ли так организовать тепловой контакт между ними,
чтобы в результате теплопередачи горячее тело стало холодным, а холодное -
горячим? Возможен ли полный обмен
температурами (или почти полный)?
(первое - горячее,
второе - холодное). Можно ли так организовать тепловой контакт между ними,
чтобы в результате теплопередачи горячее тело стало холодным, а холодное -
горячим? Возможен ли полный обмен
температурами (или почти полный)?
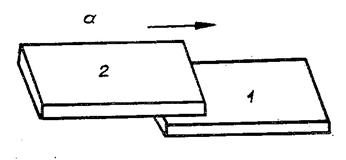
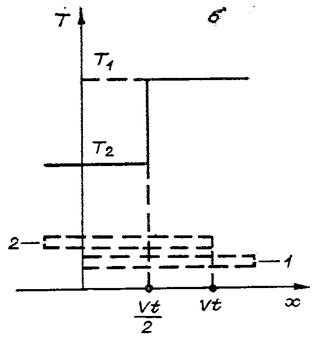
Рис.1. Скользящий контакт (а) и распределение для него температуры по пластинам (б)
Решение. Пусть тела представляют
собой одинаковые тонкие прямоугольные пластины. Проведем одну пластину по
другой так, как показано на рис. 1.1, а. Пусть 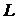 - длина пластины,
- длина пластины, 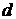 - толщина,
- толщина, 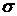 -
температуропроводность материала пластин. Если
-
температуропроводность материала пластин. Если 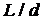 достаточно велико, то
можно выбрать такую скорость
достаточно велико, то
можно выбрать такую скорость 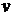
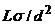
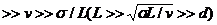 (1)
(1)
(значок >> означает «много
больше»). Для такой скорости 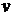 теплопереносом вдоль
пластин можно пренебречь, а теплопередачу по толщине пластин считать
мгновенной. В соответствии с этим положим температуру по толщине пластин
считать постоянной, температуру обеих пластин в точках контакта равной и
запишем закон сохранения энергии:
теплопереносом вдоль
пластин можно пренебречь, а теплопередачу по толщине пластин считать
мгновенной. В соответствии с этим положим температуру по толщине пластин
считать постоянной, температуру обеих пластин в точках контакта равной и
запишем закон сохранения энергии:
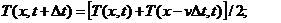 (2)
(2)
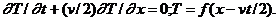
Поскольку 
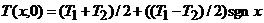
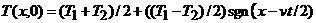 (3)
(3)
при 0£vt£L (см. рис. 1, б).Аналогично (3) верно и при 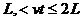
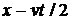 происходит резкое
изменение температур. Фронт обмена движется со скоростью
происходит резкое
изменение температур. Фронт обмена движется со скоростью 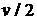
Устройства, реализующие принцип решения (противоток),
известны давно. Это обычные heat exchangers теплообменники. Тем не менее
задачи подобного типа вызывают при первом знакомстве с ними известные
трудности. Даже квалифицированным физикам часто на первый взгляд кажется, что
«упругий» теплообмен принципиально невозможен. Это вызвано «одномерной»
интуицией - если фазовое пространство одномерно, то обойти равновесие
невозможно. Если бы температура обоих тел не изменялась от точки к точке, то в
отсутствие третьих тел состояние системы при фиксированных начальных значениях 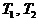 однозначно описывалось
бы задаванием температуры одного из тел в силу сохранения энергии. В простейших
случаях при постоянной одинаковой теплоемкости
однозначно описывалось
бы задаванием температуры одного из тел в силу сохранения энергии. В простейших
случаях при постоянной одинаковой теплоемкости 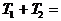 const.
const.
Рассмотрим подробнее двумерные системы (состояние - точка на плоскости). Пусть температура одного тела пространственно однородна, второе же состоит из двух половин, в каждой из которых температура также пространственно однородна, а коэффициент теплопередачи между половинами мы можем произвольно изменять от некоторой конечной величины до нуля. Предположение о пространственной однородности означает, что перенос тепла внутри тел (или, соответственно, половинок) происходит намного быстрее, чем теплообмен между ними.
По сути здесь мы имеем дело с тремя телами. Одно из
них имеет теплоемкость с, два других
(половины второго тела) - с/2.
Обозначим их температуры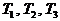
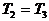
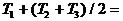 const. Поэтому для описания системы при заданной энергии
достаточно двух температур. Воспользовавшись законом сохранения, можно выразить
const. Поэтому для описания системы при заданной энергии
достаточно двух температур. Воспользовавшись законом сохранения, можно выразить
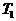 через
через 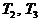
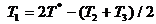
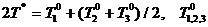

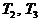 разобьем линиями частных равновесий - тремя прямыми с
уравнениями
разобьем линиями частных равновесий - тремя прямыми с
уравнениями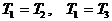 и
и 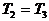
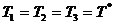
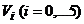 (рис. 2). Далее такие
углы называются отсеками. Каждый
отсек соответствует одной расстановке знаков в неравенствах между
(рис. 2). Далее такие
углы называются отсеками. Каждый
отсек соответствует одной расстановке знаков в неравенствах между 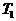 и
и 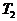
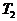 и
и 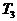
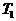 и
и 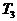 из следующих:
из следующих:
а)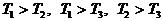
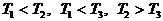
в)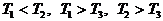
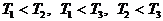
д)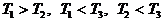
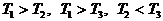
Возможны еще два способа расстановки знаков в этих
неравенствах: 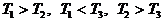 и
и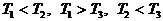
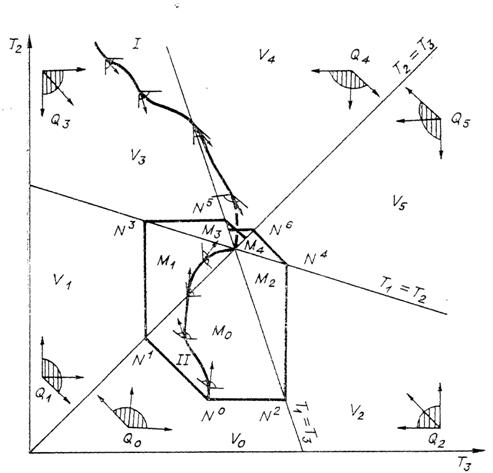
Рис. 2. Отсеки 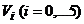
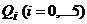 (заштрихованы),
примеры допустимых путей (I, II)
и множество состояний, достижимых из данного начального
(заштрихованы),
примеры допустимых путей (I, II)
и множество состояний, достижимых из данного начального 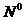 (область с выделенной
границей), для теплообмена трех тел, если одно из них имеет теплоемкость с, два других - с/2.
(область с выделенной
границей), для теплообмена трех тел, если одно из них имеет теплоемкость с, два других - с/2.
Рассмотрим движение системы при наличии контактов
между телами. Если приведены в контакт первое и второе тело, а третье
изолировано, то движение происходит вдоль прямой 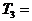 const по направлению к точке ее пересечения с прямой
const по направлению к точке ее пересечения с прямой 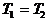
Возможное направление
движения системы
есть сумма с положительными коэффициентами направляющих векторов для парных
контактов. В каждом отсеке однозначно определен угол возможных направлений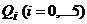
Для каждого начального состояния построим область
состояний, в которые можно попасть из него, двигаясь по допустимым путям (область достижимости). Пусть  - начальное состояние
(рис. 2),
- начальное состояние
(рис. 2),  лежит в отсеке
лежит в отсеке 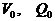 - соответствующий угол
возможных направлений. Перенесем вершину этого угла в точку
- соответствующий угол
возможных направлений. Перенесем вершину этого угла в точку 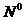 и рассмотрим его
пересечение с
и рассмотрим его
пересечение с 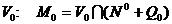
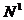 и
и 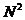 наиболее удаленные от
равновесия точки этого множества, лежащие на граничных прямых
наиболее удаленные от
равновесия точки этого множества, лежащие на граничных прямых 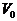
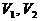
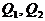
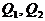 в точки
в точки 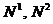 и рассмотрим их
пересечения с
и рассмотрим их
пересечения с 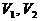 соответственно
соответственно 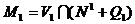 и
и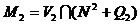
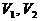 и не примыкающих
к
и не примыкающих
к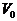
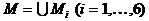
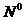
По условию исходной задачи в начальный и конечный
моменты 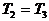
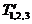 и повторяя построения
рис. 2, получим (рис. 3):если
и повторяя построения
рис. 2, получим (рис. 3):если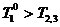
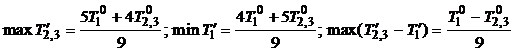 (4)
(4)
Способ реализации (4) таков: первое тело приводится в
равновесие с одной половиной второго, их температура становится равной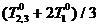
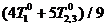
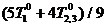
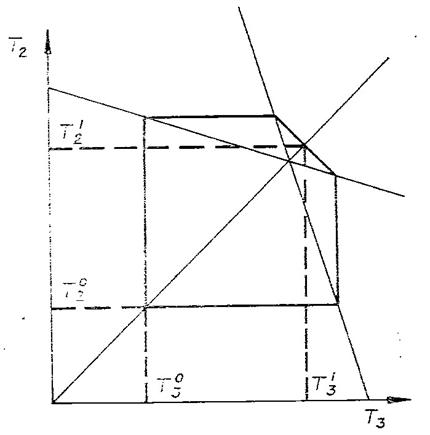
Рис. 2. Теплообмен трех тел с максимальным эффектом обхода
равновесия; в начальный и конечный моменты 
2. Закон действия масс
При описании кинетики химической реакции представляют сложную реакцию как совокупность простых (элементарных), а скорости простых реакций находят по сравнительно простому правилу. В простейшем случае скорость элементарной реакции задается законом действия масс. Такие простейшие системы называются кинетически идеальными. Элементарная реакция задается своим стехиометрическим уравнением
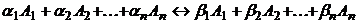 (5)
(5)
здесь 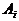 - символы веществ,
- символы веществ, 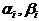 - стехиометрические коэффициенты - целые числа, показывающие, сколько
молекул
- стехиометрические коэффициенты - целые числа, показывающие, сколько
молекул 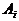 участвует в одном акте
элементарной реакции в качестве исходного реагента
участвует в одном акте
элементарной реакции в качестве исходного реагента 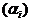 и в качестве продукта
и в качестве продукта 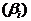
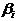 - число молекул
- число молекул 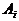
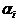 - число молекул
- число молекул 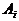
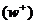 и обратной
и обратной 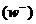 реакции суть
реакции суть
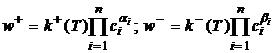 (6)
(6)
где 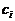 - концентрация
- концентрация 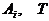 - температура,
- температура, 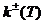 - константы скорости.
Число различных констант скорости равно
- константы скорости.
Число различных констант скорости равно 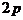
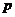 - количество различных
элементарных стадий (взаимно обратных
элементарных реакций (5)). Однако не всегда эти
- количество различных
элементарных стадий (взаимно обратных
элементарных реакций (5)). Однако не всегда эти 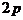 констант можно
задавать независимо.
констант можно
задавать независимо.
Ограничения на возможные значения констант могут быть
сформулированы в виде принципа детального
равновесия: для каждого T
существует такой набор положительных концентраций 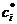 (точка равновесия),
что
(точка равновесия),
что
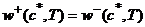 (7)
(7)
Существование такой точки детального равновесия влечет многочисленные следствия. В частности, оно связано с постоянным убыванием в ходе реакции некоторых функций. Так, для реакций, осуществляемых при постоянных объеме и температуре, монотонно уменьшается функция
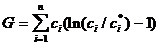 (8)
(8)
Действительно, для реакции при указанных условиях
дифференциальные уравнения, которым подчиняется динамика концентраций 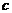
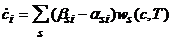 (9)
(9)
где  - номер стадии,
величины с индексом
- номер стадии,
величины с индексом  соответствуют
соответствуют 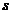
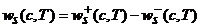
В силу этих уравнений (9) функция (8) меняется по следующему закону:
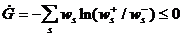 (10)
(10)
Последнее неравенство
очевидно: для любых положительных a, b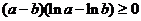 из-за того, что ln - возрастающая функция.
из-за того, что ln - возрастающая функция.
Будем рассматривать только закрытые идеальные
химические системы и реакции при постоянных объеме и температуре. Для них роль
второго начала термодинамики играет утверждение: функция 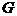 (8) в ходе химической
реакции должна убывать (не возрастать).
(8) в ходе химической
реакции должна убывать (не возрастать).
3. Изомеризация
Если реагирующая смесь состоит только из двух веществ
- изомеров 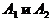
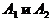 суть
суть 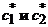
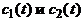 монотонно приближаются
к
монотонно приближаются
к 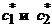
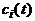 (
(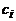 - концентрация i-го вещества) не произволен
и аналог монотонности существует. Это связано с существованием убывающих со
временем функций состава.
- концентрация i-го вещества) не произволен
и аналог монотонности существует. Это связано с существованием убывающих со
временем функций состава.
Термодинамические
ограничения. Предполагается, что система
состоит из n изомеров 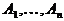 и идеальна. При
указанных условиях со временем должны убывать функция G (8). С точностью до
постоянных множителей и слагаемых G - свободная энергия системы.
и идеальна. При
указанных условиях со временем должны убывать функция G (8). С точностью до
постоянных множителей и слагаемых G - свободная энергия системы.
Если 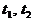 - моменты времени и
- моменты времени и 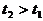
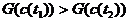
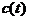 - вектор (набор)
концентраций в момент t.
Но неравенство
- вектор (набор)
концентраций в момент t.
Но неравенство 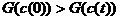 - не единственное
ограничение на возможное значение
- не единственное
ограничение на возможное значение 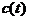 при данном
при данном 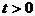
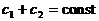
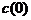
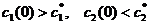
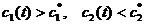
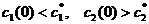
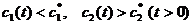
Чтобы получить аналог этого ограничения для числа
веществ 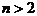 термодинамически допустимых путей реакции. В рассматриваемом случае
это такие непрерывные кривые
термодинамически допустимых путей реакции. В рассматриваемом случае
это такие непрерывные кривые 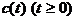
а) 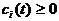 для всех
для всех 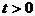
б) выполняется балансное ограничение 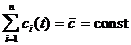
в) 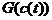 - монотонно убывающая
функция t.
- монотонно убывающая
функция t.
Переход из точки 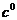 в точку
в точку 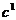 называется термодинамически разрешенным (при данных
условиях), если существует термодинамически допустимый путь реакции
называется термодинамически разрешенным (при данных
условиях), если существует термодинамически допустимый путь реакции 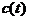
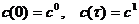 при некотором
при некотором 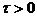
Для изучения термодинамически
запрещенных переходов оказывается полезным рассмотреть поверхности уровня
функции G, задаваемые уравнениями 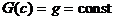 g
эти поверхности становятся несвязными -распадаются на отдельные куски (связные
компоненты), лежащие в симплексе
g
эти поверхности становятся несвязными -распадаются на отдельные куски (связные
компоненты), лежащие в симплексе 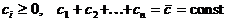
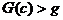
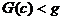 (в частности, точка
равновесия
(в частности, точка
равновесия 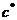
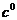
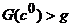
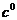
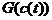
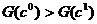
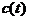
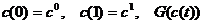 - монотонно убывающая
функция. Проиллюстрируем это графически, предельно упростив систему: пусть
изомеров всего три (
- монотонно убывающая
функция. Проиллюстрируем это графически, предельно упростив систему: пусть
изомеров всего три (
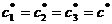
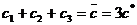 состояние системы
изображается точкой, лежащей в треугольнике
состояние системы
изображается точкой, лежащей в треугольнике 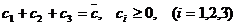
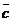 (стороной
(стороной 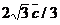
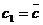
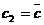
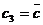
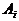 есть длина
перпендикуляра, опущенного из точки c
(изображающей состояние) на строну, противоположную вершине
есть длина
перпендикуляра, опущенного из точки c
(изображающей состояние) на строну, противоположную вершине 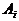 (той вершине, где
(той вершине, где 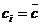 G (8). Если g близко к
G (8). Если g близко к 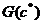
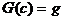 связна (рис. 4, б).
Однако если g становится больше минимума
связна (рис. 4, б).
Однако если g становится больше минимума 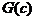 на ребрах
треугольника, но остается меньше максимума
на ребрах
треугольника, но остается меньше максимума 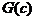 в треугольнике, то
линия
в треугольнике, то
линия 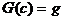 распадается на три
связные части (рис. 4, б).
распадается на три
связные части (рис. 4, б).
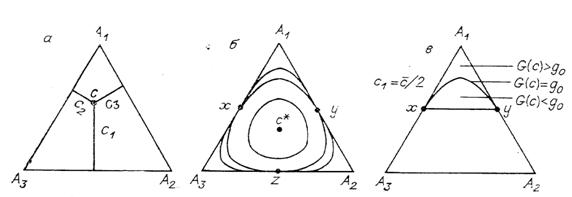
Рис. 4. Три изомера: а – система координат, б
– линии уровня G, в – область недоступности вблизи 
Минимум 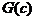 на ребрах треугольника
достигается на их серединах, совпадает для всех ребер (так как
на ребрах треугольника
достигается на их серединах, совпадает для всех ребер (так как 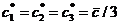
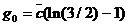
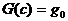
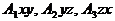 (одна сторона каждого
из них есть участок кривой
(одна сторона каждого
из них есть участок кривой 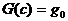
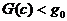
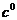
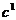 G не
возрастает). Это невозможно даже в том случае, когда
G не
возрастает). Это невозможно даже в том случае, когда 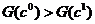
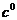 к
к 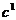 траектория должна
пересечь «изнутри» (со стороны меньших значений G) одну из дуг кривой
траектория должна
пересечь «изнутри» (со стороны меньших значений G) одну из дуг кривой 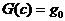 (рис. 4, б).
Допустимость перемещений внутри треугольников и в области
(рис. 4, б).
Допустимость перемещений внутри треугольников и в области 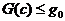 определяется по
справедливости неравенства
определяется по
справедливости неравенства 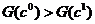
а) 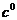 и
и 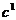 лежат обе в одном из
криволинейных треугольников
лежат обе в одном из
криволинейных треугольников 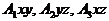
б) 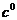 лежит в одном из
криволинейных треугольников
лежит в одном из
криволинейных треугольников 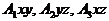
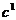 - в области
- в области 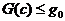
в) 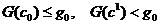 -
-
тогда перемещение из 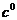 в
в 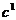 термодинамически
разрешено в том и только в том случае, когда
термодинамически
разрешено в том и только в том случае, когда 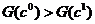
Вблизи каждой вершины есть область (примыкающий
криволинейный треугольник), в которую невозможно попасть извне. Возникает
интересный вопрос: насколько можно приблизиться к данной вершине (для определенности
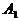
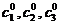
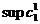
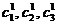 - состояние, в которое
можно перейти из
- состояние, в которое
можно перейти из 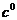
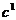
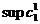 надо искать таким
образом:
надо искать таким
образом:
а) если 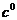 лежит в
лежит в 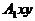 или в области
или в области 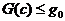
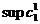 есть максимум
есть максимум 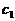 на линии
на линии 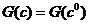
б) если 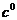 лежит в
лежит в 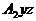 или
или 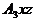
 есть максимум
есть максимум 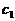 на линии
на линии 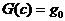
Чтобы найти  для данного
для данного 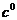
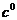 той или иной области.
Эти критерии выглядят так:
той или иной области.
Эти критерии выглядят так: 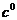 лежит в области
лежит в области 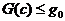 тогда и только тогда,
когда
тогда и только тогда,
когда 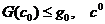 лежит в
лежит в 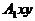 тогда и только тогда,
когда
тогда и только тогда,
когда 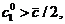
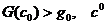 лежит в
лежит в 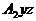 тогда и только тогда,
когда
тогда и только тогда,
когда 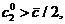
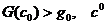 лежит в
лежит в 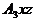 тогда и только тогда,
когда
тогда и только тогда,
когда 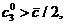
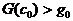
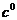
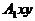 получен так (рис. 4,
в): криволинейный треугольник
получен так (рис. 4,
в): криволинейный треугольник 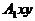 состоит из тех и
только тех точек прямоугольного треугольника
состоит из тех и
только тех точек прямоугольного треугольника 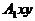
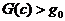
Из симметрии системы ясно, что 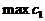 на линии уровня
на линии уровня 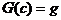 достигается на прямой
достигается на прямой 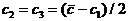
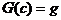 находятся из уравнения
находятся из уравнения
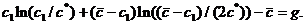 (11)
(11)
На рис. 5, а представлена зависимость 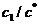 от
от 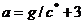 для решения (11):
для решения (11): 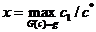
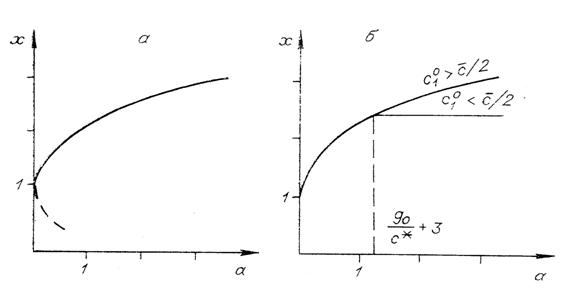
Рис. 5. Решения уравнения (11) (а) и две ветви
зависимости 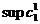 от
от 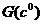 (б).
(б).
Используя решение (11), можно найти, как изменяется 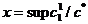 в зависимости от
в зависимости от 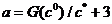 (рис. 5, б). При
(рис. 5, б). При 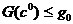 эта зависимость
однозначна. Если
эта зависимость
однозначна. Если 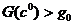
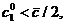 (
(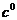 лежит в
лежит в 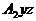 или
или 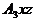
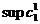 равен максимуму
равен максимуму 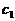 на линии
на линии 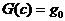 (нижняя ветвь графика
на рис. 5, б), если же
(нижняя ветвь графика
на рис. 5, б), если же 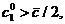
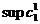 от
от 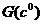 дается решением
уравнения (11) (верхняя ветвь графика на рис. 5, б).
дается решением
уравнения (11) (верхняя ветвь графика на рис. 5, б).
В одномерной системе (два изомера) с единичной
константой равновесия (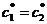
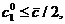
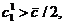
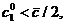 то
то 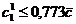 (
(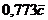 приближенное значение
решения (11) при
приближенное значение
решения (11) при 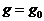
Ограничения, связанные
с механизмом реакции. Термодинамические
ограничения определяются только списком реагентов, положением точки равновесия
и видом функции G (8). Они будут справедливы
даже в том случае, если допускаются элементарные стадии, скажем, вида 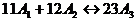
а) 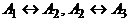
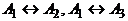
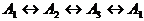
Пусть, как и выше, 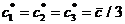
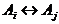 она в данном примере
задается уравнением
она в данном примере
задается уравнением 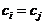
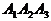 на отсеки, в которых однозначно определено
направление каждой реакции - прямое или обратное (рис. 6, а-в). Стадия
на отсеки, в которых однозначно определено
направление каждой реакции - прямое или обратное (рис. 6, а-в). Стадия 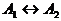 сдвигает систему вдоль
прямой
сдвигает систему вдоль
прямой 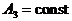 по направлению к линии
равновесия
по направлению к линии
равновесия  угол возможных
направлений движения (см. Рис. 6, а-г для
различных механизмов реакции). Если же точка лежит на линии равновесия
какой-нибудь стадии, то ей сопоставляется угол, совпадающий с пересечением
углов прилегающих отсеков.
угол возможных
направлений движения (см. Рис. 6, а-г для
различных механизмов реакции). Если же точка лежит на линии равновесия
какой-нибудь стадии, то ей сопоставляется угол, совпадающий с пересечением
углов прилегающих отсеков.
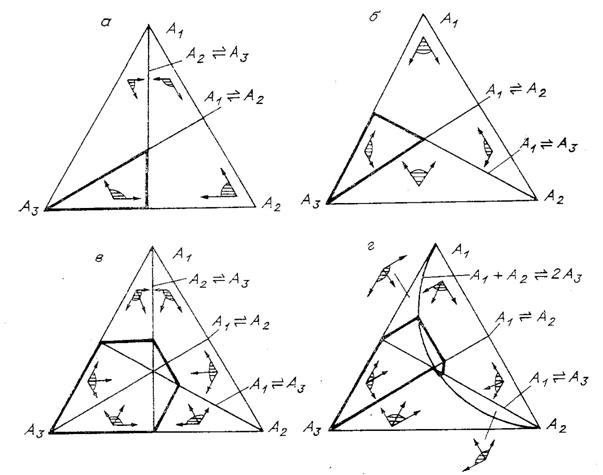
Рис. 6. Рис. 6. Составы,
достижимые из  (области с выделенной
границей), для различных механизмов реакции:
(области с выделенной
границей), для различных механизмов реакции:
а - 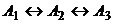
б - 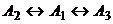
в - 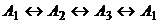
г - 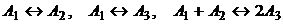
указаны линии равновесия стадий и углы возможных направлений (заштрихованы).
Гладкая кривая 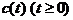 есть допустимый путь
реакции, если
есть допустимый путь
реакции, если
а) 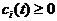 для любых
для любых 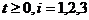
б) 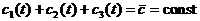
в)касательный вектор 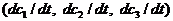 принадлежит углу
возможных направлений, соответствующему точке
принадлежит углу
возможных направлений, соответствующему точке 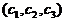 (см. рис. 6).
(см. рис. 6).
Описанные допустимые пути и термодинамически допустимы
- вдоль них монотонно убывает функция 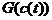
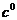 к составу
к составу 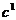 допустим тогда и
только тогда, когда существует такой допустимый путь
допустим тогда и
только тогда, когда существует такой допустимый путь 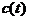
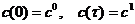 для некоторого
для некоторого 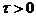
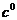
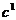
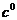 к
к 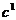
На рис. 6, а-в изображены множества достижимых
состояний M для различных механизмов
реакции и начального состояния 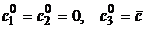
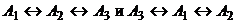 множество M при таком начальном
состоянии совпадает с
множество M при таком начальном
состоянии совпадает с 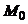 (рис. 6, а, б). Для
большего механизма
(рис. 6, а, б). Для
большего механизма 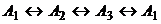 множество M существенно шире (рис. 6,
в). Для механизма
множество M существенно шире (рис. 6,
в). Для механизма 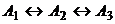 и данного начального
состояния значение
и данного начального
состояния значение 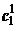 не превосходит
не превосходит 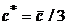
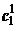 не превосходит
не превосходит 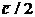 (как и в одномерном
случае).
(как и в одномерном
случае).
Покажем все на том же примере (три изомера, 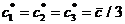
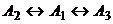 стадией
стадией 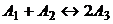 (механизм (г)). Ее
линия равновесия задается уравнением
(механизм (г)). Ее
линия равновесия задается уравнением 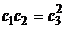 (все при том же
условии
(все при том же
условии 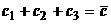
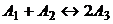 система движется вдоль
прямой, параллельной биссектрисе угла
система движется вдоль
прямой, параллельной биссектрисе угла 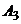 (рис. 6, г).
Направляющий вектор имеет компоненты (1, 1, -2). Максимальное значение
(рис. 6, г).
Направляющий вектор имеет компоненты (1, 1, -2). Максимальное значение 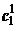 для
для 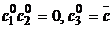 дает допустимый путь,
состоящий из двух прямолинейных отрезков - движения от
дает допустимый путь,
состоящий из двух прямолинейных отрезков - движения от 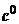 к точке
к точке 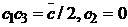 вдоль линии
вдоль линии 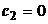 и движения от этой
точки вдоль прямой, параллельной биссектрисе угла
и движения от этой
точки вдоль прямой, параллельной биссектрисе угла 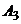
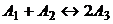
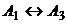
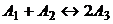
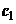 в конце пути есть
в конце пути есть 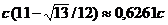
Таким образом, при наличии в механизме реакции стадии с взаимодействием различных веществ обход равновесия не запрещен. Для каждого конкретного механизма реакции множество допустимых путей (и достижимых состояний) уже, чем множество термодинамически допустимых путей.
Заключение
Общие запреты для направлений протекания процессов, общие ограничения на величину различных эффектов дают нам принципы термодинамики.
И в жизни, и в науке принципы нужны для уничтожения гипотез, идей, конструкций. Так, закон сохранения энергии связан с уничтожением вечных двигателей первого рода (черпающих энергию из ничего), второе начало термодинамики - с уничтожением вечных двигателей второго рода (черпающих энергию из равновесно распределенного тепла). Принципы - средство массового уничтожения: истребляются сразу все упомянутые конструкции. И невозможно, и не нужно обсуждать новые вечные двигатели - для этого надо сначала всерьез уничтожить принципы термодинамики.
Но столь серьезное средство нуждается в столь же внимательном и бережном отношении. Рассмотрение эффектов обхода равновесия позволит яснее понять, как устроены термодинамические ограничения на динамику неравновесных систем, что запрещено, а что – нет.
Литература
Пригожин И., Дефей Р. Химическая термодинамика. Новосибирск: Наука, 1966. 510 с. (Прекрасное изложение базовых понятий термодинамики.)
Gorban A.N. Invariant sets for kinetic equations // React. Kinet. Catal. Lett., 1978. V. 10, № 2. PP. 187-190. (Первая работа по областям достижимости и допустимым путям.)
Горбань А.Н., Яблонский Г.С., Быков В.И. Путь к равновесию // Математические проблемы химической термодинамики. Новосибирск: Наука, 1980. С. 37-47.29. (Первая подробная статья.)
Gorban A.N., Jablonsky G.S., Bykov V.I. The
path to equilibrium // Intern. Chem.
Горбань А.Н. Обход равновесия. Новосибирск: Наука, 1984. 224 с. (Первое детальное изложение теории термодинамических ограничений и эффектов обхода равновесия.)
Shinnar R., Feng C., Structure of complex chemical reactions.Thermodynamic constrains in kinetic modeling and catalyst evaluation, Ind. and Eng. Chem. Fund., V. 24 (1985), No. 2, 153-170. (Изложениетеориитермодинамическихограниченийнапростейшихпримерах.)
Shinnar R., Thermodynamic analysis in chemical process and reactor design, Chem. Eng. Sci., 43, Iss. 8 (1988), 2303-2318. (Изложены принципы приложения теории термодинамических ограничений к конструированию реакторов на простейших примерах.)
Vuddagiri S.R.,
Hall K.R., Eubank Ph.T., Dynamic modeling
of reaction pathways on the Gibbs energy surface.
Каганович Б.М., Кучменко Е.В., Шаманский В.А., Ширкалин И.А. Термодинамическое моделирование фазовых переходов в многокомпонентных системах // Изв. РАН. Энергетика. – 2005. – № 2. – С. 114-121.
Каганович Б.М., Кейко А.В., Шаманский В.А., Ширкалин И.А. Описание неравновесных процессов в энергетических задачах методами равновесной термодинамики // Изв. РАН. Энергетика. – 2006. – № 3. – С. 64-75.
GorbanA.N., KaganovichB.M., FillipovS.P., Keiko A.V., Shamansky V.A., Shirkalin I.A., Thermodynamicequilibriaandextremes: Analysisofthermodynamicaccessibleregionsandpartialequilibriainphysical, chemical, andtechnicalsystems. Springer, 2018. (Обзор вычислительных алгоритмов термодинамического анализа и его приложений к реальным и модельным системам.)
Термодинамически допустимые пути неравновесных процессов. – сайт с книгами и статьями разных авторов по термодинамике и кинетике. Включает работы [2, 6, 11], ряд учебников и монографий.