Ароматичні вуглеводні
| Разделы | Химия |
| Тип | |
| Формат |
|
| Язык | Украинский |
| Загрузить архив: | |
| Файл: 026-0018.zip (55kb [zip], Скачиваний: 155) скачать |
Опорний конспект
на тему:
"Ароматичні вуглеводні"
Виконав:
учень 10 - А класу
середньої школи № 96
Коркуна Дмитро
1. Ненасичені вуглеводні – це органічні сполуки, що складають ся з Карбону і Гідрогену, в яких атоми Карбону не повністю насичені атомами Гідрогену.
Загальна формула етиленових вуглеводнів – CnH2n
Загальна формула ацетиленових вуглеводнів CnH2n-2
2. Гомологи етилену Гомологи ацетилену:
С2H4 – етилен; C2H2 – ацетилен;
С3H6 – пропен; C3H4 – пропин
C4H8 – бутен; C4H6 – бутин
І т .д І т д
Радикали: СН3 – метил; С2Н5 – етил; С3Н7 пропіл;
Радикал – це атом або група атомів, що містить неспарені електрони
3. Етилен:
С2Н4 Н2С – 2 Н
: С : :С : Н
2 Н
: С : :С : Н
Н Н
молекулярна струтурна електронна формули
Ацетилен:
С2Н2 НС ºCH H : C 

H H
Молекулярна структурна електронна формули
Фізичні властивості:
Етилен – безбарвний газ, майже без запаху, малорозчинний у воді, трохи легший за повітря
Ацетилен – безбарвний газ, без запаху, малорозчинний у воді.
Хімічні властивості:
1. як і інші вуглеводні, етилен і ацетилен горять на повітрі з утворенням оксиду карбону (ІV) і води:
СН2 = СН2 +3 О2 ® 2СО2 + Н2О
2СН ºСН+5О3 ®4СО2 +2 Н2О ▲Н = 1307 к Дж.моль
СН4 – W( C) =75%; C2H4 – W( C) =86 %; C2H2 - W( C) = 92%
Чим менша кількість С, тим світліше полум'я
2. Гідрування – приєднання водню
Н2С = СН2 +Н2
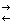 (t0, pt, N) H3C
– CH3
(t0, pt, N) H3C
– CH3
3. Гідратація – приєдання води
4.
Н2С = СН2
+ Н2О 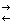 (t0 , H2SO4)
CH3 – CH2 OH
(t0 , H2SO4)
CH3 – CH2 OH
4. Якісні реакції
Неповне окиснення Н2С = СН2 +[O] 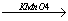 CH2 – OH
CH2 – OH
|
CH2 – OH
5. Галогенування – приєднання галогеноводню
Н2С = СН2 +Сl2 ® CH2Cl –CH2Cl
6. приєднання галогеноводню, правило Марковніка. При взаємодії ненасичених вуглеводнів з галогеноводнями атом Гідрогену приєднується до більш гідрогенізованого атома Карбону а атом Хлору – до менш гідронізованого





 Н3С – СН º СН2 +HCl ® HC3 –CHCl –CH3
Н3С – СН º СН2 +HCl ® HC3 –CHCl –CH3
6. Дегідрування
7.
Н2С = СН2 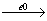 º СН + Н2
º СН + Н2
4. Характерна ізомерія за місцем розташування подвійного зв'язку:
а) ізомери
СН3 – СН = СН2 – СН3 – 2 бутен
СН2 = СН – СН2 – СН3 – 1 бутен
б) Ізомерія карбонового скелету
СН2 = С – СН3
|
CH3
-1-
Добування ецителену і ацетилену
Етилен та його гомологи утворюють в процесі переробки вуглеводнів, що містяться в нафті. Утворення може відбуватися у результаті термічного розщеплення ненасичених вуглеводнів,.
СН3
–СН2 – СН2 – СН2 – СН3 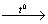 СН2 = СН2 + СН3 –СН2 – СН3
СН2 = СН2 + СН3 –СН2 – СН3
Ацетилен, що використовуэться для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію з водою: СаС2 + 2Н2О ® НС º СН +Са(ОН)2
Карбід кальцію добувають в результаті нагрівання в електропечах суміші вапна СаО та коксу до температури 2500 0 С: СаО + 3С ®СаС2 +СО
Економічно вигідніше добувати ацетилен з метану нагріванням до температури 15000 С.
2СН4 ® НС º СН + 3Н2
Застосування етилену і ацетилену
З етилену добувають поліетилен, етиловий спирт. Продукт приєднання хлору до етилену –1,2 -дихлорометан є розчинником і засобом знищення шкідників. А продукт приєднання хлороводню – хлороетан є анестезійною речовиною.
Ацетилен використовують для освітлення, для газового різання і зварювання металів. Ацетиленове кисневе полум'я має температуру 2800о С і легко плавить сталь. З ацетилену добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти.
-2-
1. Ароматизовані вуглеводні – органічні сполуки, що містять у своєму складі бензольні ядра , у яких можуть бути насичені або ненасичені бічні ланцюги.
Загальна формула – СnH2n-6
1. гомологи бензолу:
бензол – C6H6;тонуол –C7H8 ; ксилол – C8H10; стирол – C9H12.
3. Бензол:
С6Н6 СН2 = СН –С º С–СН = СН2 або СНºС–СН2–СН2–cºCH
Молекулярна структурні формули
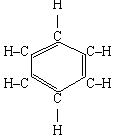
Формула А. Кекуле
У 1845 р. німецький учений А. Кекуле зппропонував формулу, що найкраще відобразила рівноцінність і атомів Карбону, і атомів гідрогену
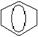 |
Після з'ясування електронної будови молекули бензолу, формулу почали записувати так:
2.Фізичні влстивості бензолу:
За звичайних умов бензол – рідина зі специфічним запахом, tкип. 80о С, уводі практично нерозчинний, хоча є розчинником багатьох органічних речовин.
5. Хімічні властивості:
Бензолу характерні реакції заміщення і приєднання:
3. реакція горіння
2С6Н6 +15О2 ®12СО2↑ + 6Н2О
4. Бромування:
Б-Н +Br2
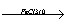 Б-Br +HBr;
Б-Br +HBr;
5. Нітрування:
Б-Н + НО–NO2 ®(Н2SO4)Б-NO2 + H2O
4. Реакції приєднання:
|
Cl2 |
|
Cl2 |
|
Б+3Cl2®(n,v) |
|
Cl2 |
|
Cl |
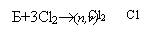 |
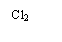 |
||
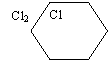
а) Хлорування:
|
Cl2 |
|
Cl |
 |
б)Б+3Н2
 (k,H2C)C6H12
(k,H2C)C6H12
5. Добування
1. меридизація ацетилену:
3НСºСН®([C], 600o) Б
2. Дегідрування циклогексану
С6Н12 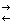 3Н2 + Б
3Н2 + Б
6. Застосування
Бензол є вихідною речовиною речовиною для синтезу величезної кількості неорганічних речовин. Серед них – барвники, лікарські препарати, пахучі речовини, полімери, отрутохімікати, вибухові речовини. Бензол – базова сировина для прмислового органічного синтезу
-1-