Эволюция биологических механизмов запасания энергии
| Загрузить архив: | |
| Файл: ref-10779.zip (1734kb [zip], Скачиваний: 115) скачать |
Содержание:
Эволюция биологических механизмов запасания энергии
1. "Ультрафиолетовый фотосинтез" с аденином в качестве антенны, улавливающей свет
2. Аденинсодержащие коферменты
3. Рнк, Днк, белки и мембраны
Как избежать разрушительных эффектов ультрафиолетового света
1. Запасные энергетические ресурсы и гликолиз
2. Протонные каналы и Н+-атфаза предотвращают закисление клетки при гликолизе
Возникновение фотосинтеза, использующего видимый свет
1. Бактериородопсиновый фотосинтез
2. Хлорофилльный фотосинтез
3. Дыхательный механизм энергообеспечения
ФОТОСИНТЕЗ И БИОСФЕРА
1. Запасание энергии
2. Ассимиляция двуокиси углерода
3. Выделение молекулярного кислорода
4. Молекулярные основы преобразования и запасания энергии света при фотосинтезе
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ЭВОЛЮЦИЯ БИОЛОГИЧЕСКИХ МЕХАНИЗМОВ ЗАПАСАНИЯ ЭНЕРГИИ
Использование внешних энергетических ресурсов для совершения полезной работы - универсальна функция всех живых систем. Столь же непреложным фактом является то обстоятельство, что химия современной жизни базируется прежде всего на процессах, осуществляемых белками и нуклеиновыми кислотами. Что касается белков, то их выдающаяся роль в жизненных явлениях объясняется, скорее всего, необычайным разнообразием свойств молекул этого класса, обусловленным наличием в их структуре самых различных химических группировок, которые удается уникальным образом расположить в пространстве. Вот почему среди биохимиков бытует афоризм: "Белок может все". Однако в явном противоречии с этой максимой находится факт, состоящий в том, что такие важнейшие функции клетки, как хранение и реализация генетической информации, обеспечиваются прежде всего нуклеиновыми кислотами, а составляющие их мономеры-нуклеотиды используются клеткой в качестве коферментов и "конвертируемой энергетической валюты". В принципе можно представить себе, например, особый белок, кодирующий структуру других белков (как думал когда-то Н.К. Кольцов) или конферменты, сделанные из аминокислот либо другихвеществ ненуклеотидной природы. И если этого в действительности не происходит, то нужно искать какие-то достаточно веские основания. Ниже изложена концепция, предполагающая, что решение загадки лежит в происхождении жизни.
Современные биохимические механизмы, без сомнения, несут на себе отпечаток эволюционного прошлого, так сказать, "родимые пятна" своей истории. Не исключено, что выбор пал на нуклеиновые кислоты по причине, сегодня уже не актуальной, но сыгравшей решающую роль на заре становления живых систем.
"УЛЬТРАФИОЛЕТОВЫЙ ФОТОСИНТЕЗ" С АДЕНИНОМ В КАЧЕСТВЕ АНТЕННЫ, УЛАВЛИВАЮЩЕЙ СВЕТ
Синтез АТФ из АДФ под действием ультрафиолетового света.Путь от смеси органических и неорганических молекул к первой живой клетке был, по-видимому, столь долог, что требовался некий постоянный источник энергии, доступный в течение всего периода возникновения жизни. Среди возможных кандидатов на роль такого источника, пожалуй, предпочтительнее всего ультрафиолетовый свет. Он поглощается любыми химическими веществами, резко повышая их реакционную способность благодаря большому запасу энергии ультрафиолетового кванта. Есть основания считать, что на заре биологической эволюции ультрафиолетовые кванты свободно достигали поверхности Земли, лишенной в те времена современной кислородсодержащей атмосферы с ее поглощающим ультрафиолетовый свет озоновым слоем.
Моделируя атмосферу древнейшей Земли. К. Саган пришел к выводу о существовании в ней "окна" в области 240—290 нм, прозрачного для ультрафиолетового света, поскольку основные простые компоненты этой атмосферы (Н2О, СН4, NH3, CO2, CO и HCN) поглощают свет короче 240 нм, а формальдегид, также входивший, как полагают, в ее состав, имеет максимум поглощения длиннее 290 нм. Именно в этом "окне" располагаются спектральные максимумы пуринов и пиримидинов.
Еще в 60-е годы С. Понамперума и сотрудники экспериментально показали, что облучение ультрафиолетовым светом синильной кислоты ведет к химическому синтезу аденина и гуанина. Обнаружено также, что облучение смеси метана, аммиака, водорода и воды вызывает образование как пуринов, так и пиримидинов, причем с наибольшим выходом для аденина. Ультрафиолетовый свет можно использовать также для синтеза аденозина из аденина и рибозы и далее аденозинмоно- и дифосфатов из аденозина и этилметафосфата. Но, пожалуй, наиболее важный опыт был поставлен теми же авторами с АДФ. Оказалось, что облучение смеси АДФ и этилметафосфата ультрафиолетовым светом дает АТФ с достаточно хорошим выходом, причем этот процесс демонстрируется в строго стерильных условиях и в отсутствие каких-либо белков.
К. Саган и С. Понамперума приводят следующие доводы в пользу заключения о том, что в качестве антенны для ультрафиолетового света аденин имеет преимущества по сравнению с другими пуринами и пиримидинами: 1) наибольшее поглощение света в спектральном "окне", о котором шла речь выше; 2) наибольшая стабильность к разрушительному действию ультрафиолетового света и 3) большее время жизни возбужденного состояния, возникающего в ответ на поглощение ультрафиолетового кванта.
Расчеты Л.А. Блюменфельда и М.И. Темкина привлекли наше внимание к тому факту, что величины изменения свободной энергии при нарушении ароматической структуры аденина близки к энергии реакции синтеза АТФ из АДФ и неорганического фосфата.
Приняв во внимание все названные выше обстоятельства, мы предположили следующий механизм фосфорилирования за счет ультрафиолетового света в первичных живых клетках:
1) адениновая часть АДФ поглощает ультрафиолетовый квант, что переводит ее в возбужденное состояние с нарушенной системой двойных связей. При этом аминогруппа аденина, соответствующая в обычном состоянии ароматической, приобретает свойства алифатической, что облегчает ее электро-фильную атаку атомом фосфора неорганического фосфата;
2) возбужденный аденин АДФ фосфорилируется, давая изомер АТФ, третий фосфорил которого находится при аминогруппе аденина;
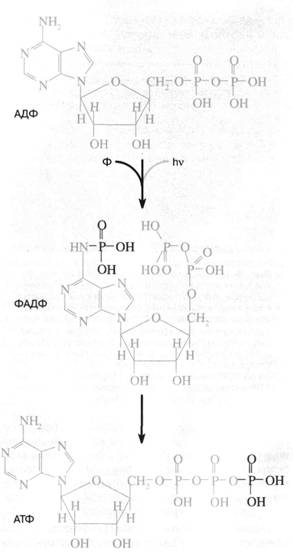
3) фосфорил переносится с аденина на конечный (второй) фосфат АДФ. Такой перенос должен облегчаться тем обстоятельством, что расстояние между аминогруппой аденина и вторым фосфатом в АДФ в точности равно размеру еще одного (третьего) фосфатного остатка. Перенос фосфорила с аде-ниновой "головы" нуклеотида на фосфатный "хвост" должен сопровождаться его стабилизацией, поскольку весьма лабильный фосфоамид заменяется на менее лабильный фосфоангидрид (рис. 1).
Стадии 2 и 3 гипотетичны и призваны объяснить механизм синтеза АТФ под действием ультрафиолетового света в опытах С. Понамперумы и сотрудников [3].
АДЕНИНСОДЕРЖАЩИЕ КОФЕРМЕНТЫ
Аденин и реже другие пурины или пиримидины входят в состав ключевых коферментов и простетических групп ферментов, таких, как никотинамидадениндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ+), флавинадениндинуклеотид (ФАД), кофермент А (КоА), тиаминопирофосфат (производное витамина В,), витамин В12. Все эти соединения, как правило, построены по одному и тому же принципу. Они содержат: 1) ту или иную функциональную группу, непосредственно участвующую в катализе, 2) пурин или реже пиримидин и 3) гибкую связку, позволяющую сблизить две другие части молекулы. Особенно наглядно устройство динуклеотидов: в них плоские остатки никотинамида (в НАД+ и НАДФ+) или изоаллоксазина (в ФАД) лежат на также плоском остатке аденина. Продемонстрирован перенос энергии от остатка аденина к остатку никотинамида или изоаллоксазина в ответ на поглощение аденином ультрафиолетового кванта. Поэтому можно предположить, что аденин, возбуждаясь ультрафиолетовым светом, передавал энергию на функциональную группу кофермента, который использовал эту энергию для проведения энергоемких химических реакций (например, восстановления простых веществ среды до более сложных соединений первичной клетки).
|
|
Рис. 1. Схема "аденинового" фотосинтеза -предполагаемого первичного механизма запасания энергии в живой клетке. Квант ультрафиолетового света поглощается адениновой частью аденозиндифосфата (АДФ), переводя ее в возбужденное состояние. Возбуждение облегчает присоединение неорганического фосфата (Ф) к аминогруппе аденина. В результате образуется ФАДФ, изомер аденозинтрифосфата (АТФ), где третий фосфат присоединен не к пирофосфатно-му "хвосту", а к адениновой "голове" АДФ. Затем происходит перенос фосфата от "головы" к "хвосту" с образованием обычного АТФ
РНК, ДНК, БЕЛКИ И МЕМБРАНЫ
В дальнейшем не слишком специфичный и нерегулируемый катализ, осуществляемый низкомолекулярными коферментами, был дополнен (а затем и вытеснен) процессами с участием высокомолекулярных катализаторов-ферментов, отличающихся огромной избирательностью в отношении субстратов и возможностью регулировать катализ. По-видимому, первыми ферментами были рибонуклеиновые кислоты (РНК) - полимеры, составленные из мономеров-нуклеотидов. Можно полагать, что адениновый фотосинтез катализировался комплексами РНК с магниевыми солями АДФ и фосфата. При этом РНК могла бы выполнять также роль антенны, собирающей ультрафиолетовый свет и передающей возбуждение на АДФ.
Надо сказать, что еще и сегодня в некоторых (весьма немногочисленных) случаях биохимические реакции могут катализироваться в искусственных условиях рибонуклеиновыми кислотами (так называемыми рибозимами). Однако несомненно, что каталитические функции современных организмов осуществляются белками, обладающими большим, чем РНК, разнообразием химических группировок и их сочетаний.
Синтез белков, включая кодирование их структуры, первоначально осуществлялся рибонуклеиновыми кислотами. Затем функция кодирования была передана дезоксирибонуклеиновым кислотам (ДНК), а сам катализ стал обслуживаться комплексами РНК и специальных белков (рибосомами и факторами трансляции), информационными и транспортными РНК и соответствующими ферментами.
Другим важнейшим изобретением биологической эволюции стали жиры и жироподобные вещества, прежде всего фосфолипиды. Замечательной особенностью фосфолипидов является их способность самопроизвольно, без какой-либо помощи извне, образовывать тончайшую пленку, непроницаемую для гидрофильных веществ, таких, как нуклеотиды-коферменты, РНК, ДНК, белки и углеводы. Эта пленка (мембрана) представляет собой бислой, образованный двумя рядами молекул фосфолипидов, соприкасающихся гидрофобными (углеводородными) "хвостами". При этом гидрофильные "головы" (фосфатные остатки) фосфолипидов оказываются на двух противоположных поверхностях мембраны.
С образованием мембран стало возможно говорить о первичной живой клетке, содержимое которой было отделено от внешней среды достаточно надежным барьером. Появление клетки как обособленного мельчайшего пузырька могло бы сыграть роль в защите от неблагоприятных эффектов ультрафиолетового облучения.
Как избежать разрушительных эффектов ультрафиолетового света
Запасные энергетические ресурсы и гликолиз
Ультрафиолетовый свет - обоюдоострое оружие. Он хорош тем, что способен развязать разнообразные химические реакции, среди которых могут быть полезные, как, например, фосфорилирование адениновой аминогруппы АДФ. Но в то же время (и по той же причине) ультрафиолетовый свет опасен: он может разрушить уже синтезированные молекулы живой клетки. Одним из способов уменьшить ультрафиолетовую опасность могли стать запасные вещества - энергетические ресурсы, образуемые на свету, чтобы затем использоваться в темноте. Ультрафиолетовый свет, достигающий поверхности океана, не может проникать на сколько-нибудь значительную глубину из-за мутности, наличия растворенных веществ, поглощающих ультрафиолетовые кванты и, быть может, флуктуации плотности морской воды. Фактически только очень тонкий поверхностный слой подвергается бомбардировке этими квантами. Данное обстоятельство позволяет предположить следующий механизм энергообеспечения первичных живых клеток. Под действием движения слоев жидкости в океане клетки постоянно циркулировали между тонкой верхней пленкой воды, доступной для ультрафиолетового света, и более глубокими слоями, которых он не достигал. При этом вблизи поверхности происходил синтез АТФ, использовавшегося для образования резервных соединений, которые затем расщеплялись на глубине, поддерживая ресинтез АТФ. В результате короткие экспозиции на ультрафиолетовом свету чередовались с гораздо более длительными периодами, где ультрафиолетовой опасности уже не было (рис. 2). Кроме того, резервные вещества помогали клеткам пережить ночь.
Хорошими кандидатами на роль энергетического резерва первичных клеток могли быть неорганические пиро- и полифосфаты. Они и сегодня играют эту роль у некоторых видов живых существ. Например, в клетках грибов полифосфаты образуются из АТФ в условиях избытка энергетических ресурсов и расщепляются, давая АТФ, при дефиците источников энергии. Однако в подавляющем большинстве дошедших до нас организмов функцию легко мобилизуемого энергетического резерва выполняют не полифосфаты, а углеводы. Их синтез за счет энергии АТФ (гликогенез) представляет собой длинную последовательность реакций, намного более сложную, чем синтез полифосфатов из АТФ.
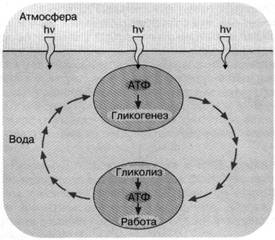
Рис. 2. Энергетика первичной живой клетки, основанная на "адениновом" фотосинтезе. Предполагается, что ультрафиолетовые кванты, достигая поверхности первичного океана, использовались клеткой для синтеза АТФ, который запускал синтез углеводородов (гликогенез). Клетка, увлекаемая потоком океанской воды с поверхности на некоторую глубину, оказывалась вне досягаемости ультрафиолетового облучения. Здесь происходило расщепление накопленных углеводов и синтез АТФ, использовавшегося для совершения клеткой различных типов полезной работы
Преимущество углеводов перед полифосфатами состоит в том, что в них запасены не только энергия, но и "строительный материал". Расщепление углеводов (гликолиз) дает помимо АТФ карбоновые кислоты, такие, как пировиноградная кислота, которая может использоваться клеткой при биосинтезе самых разнообразных соединений.
Описаны два основных типа гликолиза. В одном случае (спиртовое брожение) конечными продуктами расщепления углеводов оказываются этиловый спирт и углекислый газ — вещества, легко проникающие через мембрану клетки. Это обстоятельство имеет как преимущества (нет проблемы переполнения клетки конечными продуктами гликолиза), так и недостатки (трудно вернуться назад, к углеводу, если конечные продукты уже вышли из клетки и разбавились в океане внешней среды).
Указанный недостаток отсутствует во втором, сегодня гораздо более распространенном типе гликолиза, когда конечным продуктом оказывается молочная или какая-либо другая карбоновая кислота. Молочная кислота не проникает через мембрану, не покидает пределы клетки и потому может быть использована клеткой для ресинтеза углеводов, когда возникает такая возможность. Неудачно лишь то, что молекулы молочной кислоты, образуясь, диссоциируют с образованием ионов лактата и водорода. Последние также не могут пройти через мембрану, остаются в клетке и закисляют ее содержимое. Закисление, если его не предотвратить,
должно привести к гибели клетки из-за кислотной денатурации белков. Решение этой проблемы описано в следующем разделе.
ПРОТОННЫЕ КАНАЛЫ И Н+-АТФАЗА ПРЕДОТВРАЩАЮТ ЗАКИСЛЕНИЕ КЛЕТКИ ПРИ ГЛИКОЛИЗЕ
У современных клеток проблема проникновения через клеточную мембрану веществ, которые сами по себе не могут сквозь нее пройти, решается с помощью встроенных в мембрану белков-переносчиков. В частности, известны белки — переносчики ионов Н+. Так называемый фактор F0 — белок, входящий в состав Н+ - АТФ - синтазы, действует как переносчик Н+ или протонный канал.
Можно предположить, что у первичных гликолизирующих клеток фактор F0 функционировал при отсутствии фактора F1 второго компонента Н+ - АТФ - синтазы, разрешая ионам Н+, образующимся при гликолизе, покинуть пределы клетки. Тем самым предотвращалось закисление внутриклеточной среды, которая оказывалась в равновесии по ионам Н+ с внеклеточной средой. Единственным ограничением гликолиза в такой ситуации должно было стать закисление внеклеточной среды, что автоматически вело к закислению содержимого клетки. Снять данное ограничение можно было достроив белок - переносчик ионов Н+ (фактор F0) другим белком, называемым фактором F,. способным использовать энергию АТФ для активной откачки из клетки ионов Н+ через фактор F0. Известно, что Н+ - АТФ - синтаза (комплекс факторов F0 и fj), действуя в обратном направлении, способна катализировать вместо синтеза АТФ пиролиз АТФ, сопряженный с откачкой ионов Н+. Этот процесс носит название Н+ - АТФазной реакции. Можно полагать, что с образованием Н+ - АТФазы завершилось формирование первичной клетки, использовавшей ультрафиолетовый свет в качестве источника энергии для жизнедеятельности (рис. 3).
ВОЗНИКНОВЕНИЕ ФОТОСИНТЕЗА, ИСПОЛЬЗУЮЩЕГО ВИДИМЫЙ СВЕТ
Бактериородопсиновый фотосинтез
Со временем все меньше ультрафиолетовых квантов достигало поверхности Земли. Причиной тому было образование озонового слоя атмосферы в условиях повышения в ней концентрации кислорода. Кислород образовывался, по-видимому, вследствие фотолиза паров воды под действием того же ультрафиолетового облучения. Чтобы выжить в новых условиях, древние клетки должны были переключиться с ультрафиолетового света на какой-либо иной источник энергии, все еще доступный для них в новых условиях. Таким источником стал, вероятно, видимый свет.
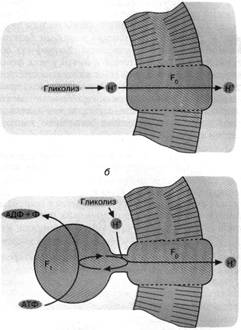
Рис. 3. Как первичная клетка могла избавиться от ионов НГ, образуемых гликолизом: а - облегченная диффузия ионов Н+ посредством белка (фактора F0), образующего Непроводящий путь сквозь клеточную мембрану; б - комплекс факторов F0 и F, (Н+ - АТФаза) активно откачивает из клетки ионы Н+ за счет гидролиза АТФ. Мембранные липиды показаны горизонтальной штриховкой, белки не заштрихованы
Другой сценарий эволюции мог бы состоять в том, что возникновение фотосинтеза, использующего видимый свет, произошло еще до помутнения атмосферы, а именно при проникновении жизни в более глубокие уровни океана, лишенные ультрафиолета. Замена опасного ультрафиолетового излучения на безопасный видимый свет могла бы быть тем признаком, который лег в основу естественного отбора на данном этапе эволюции. В рамках этой концепции создание озонового слоя имеет биогенную природу, явившись результатом фотолиза воды системой хлорофилльного фотосинтеза зеленых бактерий и цианобактерий.
Новый фотосинтез должен был, как и прежде, образовывать АТФ, который к тому времени уже прочно занял место в центре метаболической карты, выполняя роль "конвертируемой энергетической валюты" клетки. Однако аденин уже не мог играть роль улавливающей свет антенны, так как его максимум поглощения находится в ультрафиолетовой, ане в видимой области спектра. До нас дошли два типа фотосинтетических устройств, использующих видимый свет. В качестве антенны в одном из них служит хлорофилл, а в другом — производное витамина А, ретиналь, соединение с особым белком, названным бактериородопсином. Хлорофилл обнаружен у зеленых растений и почти у всех фотосинтезирующих бактерий. Исключение составляет одна группа соле- и теплоустойчивых архебактерий, содержащих бактериородопсин. Тем не менее именно бактериородопсин выглядит как эволюционно первичный механизм запасания клеткой энергии видимого света.
Бактериородопсин — светозависимый протонный насос. Он
способен активно откачивать ионы Н+ из клетки за счет энергии
видимого света, поглощенного ретиналевой частью его
молекулы. В результате световая энергия превращается в трансмембранную
разность электрохимических потенциалов ионов Н+ (сокращенно
протонный потенциал, или ∆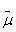 Н+). Для бактерий ∆
Н+). Для бактерий ∆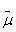 Н+ - это свободная энергия ионов Н+,
откачанных из клетки во внешнюю среду. Ионы Н+ как бы стремятся
вернуться в клетку, где их стало меньше и где возник недостаток положительных
электрических зарядов из-за действия бактериородопсинового
Н+ - насоса. Энергия света, запасенная таким образом в виде ∆
Н+ - это свободная энергия ионов Н+,
откачанных из клетки во внешнюю среду. Ионы Н+ как бы стремятся
вернуться в клетку, где их стало меньше и где возник недостаток положительных
электрических зарядов из-за действия бактериородопсинового
Н+ - насоса. Энергия света, запасенная таким образом в виде ∆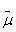 Н-, освободится, если позволить ионам Н+
войти обратно в клетку. У микробов, имеющих бактериородопсин,
ионы Н+ входят через комплекс факторов F0 и F1 таким образом, что освобождающаяся
энергия используется для синтеза АТФ. Нетрудно представить себе, как возник
фотосинтез АТФ, катализируемый бактериородопсином и
комплексом F0F1 С появлением бактериородопсина клетка
научилась создавать ДДН+ за счет видимого света, а эта ∆
Н-, освободится, если позволить ионам Н+
войти обратно в клетку. У микробов, имеющих бактериородопсин,
ионы Н+ входят через комплекс факторов F0 и F1 таким образом, что освобождающаяся
энергия используется для синтеза АТФ. Нетрудно представить себе, как возник
фотосинтез АТФ, катализируемый бактериородопсином и
комплексом F0F1 С появлением бактериородопсина клетка
научилась создавать ДДН+ за счет видимого света, а эта ∆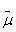 Н+, образовавшись, просто развернула
вспять Н+ - АТФазную реакцию,
существовавшую ранее в качестве механизма откачки из клетки гликолитических ионов Н+. Так комплекс F0F1 мог превратиться из АТФазы в АТФ-синтетазу (рис. 4).
Н+, образовавшись, просто развернула
вспять Н+ - АТФазную реакцию,
существовавшую ранее в качестве механизма откачки из клетки гликолитических ионов Н+. Так комплекс F0F1 мог превратиться из АТФазы в АТФ-синтетазу (рис. 4).
Устройство
бактериородопсина намного проще системы хлорофилльного фотосинтеза. Белковая часть бактериородопсина представляет собой одну полипептидную
цепь средней длины, которая не содержит других коферментов и простетических групп, кроме ретиналя.
Бактериородопсин чрезвычайно устойчив: без потери
активности его можно кипятить в автоклаве при + 130°С, изменять содержание NaCl в
омывающем мембрану растворе от нуля до насыщения, в широких пределах менять рН этого раствора. Более того, можно удалить выступающие
из мембраны концевые участки полипептидной цепи и даже расщепить эту цепь в
одном месте по середине без ущерба для активности насоса. В то же время
эффективность бактериородопсина как преобразователя
энергии сравнительно низка: всего 20% энергии светового кванта превращается в ∆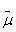 Н+. При этом на один поглощенный
квант через мембрану переносится один ион Н+.
Н+. При этом на один поглощенный
квант через мембрану переносится один ион Н+.
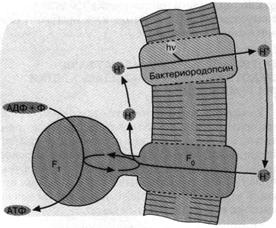
Рис. 4. Бактериородопсиновый фотосинтез со-лелюбивых архебактерий. Ионы 1-Г откачиваются из клетки бактериородопсином - белком, содержащим ретиналь в качестве хромофора, то есть группировки, поглощающей видимый свет. Ионы Н* возвращаются в клетку, двигаясь "под гору" через Н+ -АТФазный комплекс F0F,. При этом оказывается, что Н+ - АТФаза катализирует обратную реакцию, то есть синтез АТФ, а не его гидролиз
Хлорофилльный фотосинтез
Хлорофилльный фотосинтез отличается от бактериородопсинового большей эффективностью использования светового кванта. Он устроен таким образом, что либо на каждый квант переносится через мембрану не один, а два иона Н+, либо помимо транспорта Н+ происходит запасание энергии в форме углеводов, синтезируемых из С02 и Н2О. Вот почему бактериородопсиновый фотосинтез был оттеснен эволюцией с авансцены. Он сохранился только у бактерий, живущих в экстремальных условиях, где более сложный и менее устойчивый хлорофилльный фотосинтез, по-видимому, просто не может существовать.
Хлорофилльный фотосинтез катализируется ферментной системой, включающей несколько белков. Квант света поглощается хлорофиллом, молекула которого, перейдя в возбужденное состояние, передает один из своих электронов в фотосинтетическую цепь переноса электронов. Эта цепь представляет собой последовательность окислительно-восстановительных ферментов и коферментов, находящихся во внутренней мембране бактерий или хлоропластов растений, где локализованы также белки, связанные с хлорофиллом. Компоненты цепи содержат, как правило, ионы металлов с переменной валентностью (железо, медь, реже марганец или никель). При этом железо может входить в состав тема (в таком случае белки называются цитохромами). Большую роль играют также негемовые железопротеиды, где ион железа связан с белком через серу цистеина или реже азот гистидина. Помимо ионов металлов роль переносчиков электронов играют производные хинонов, такие, как убихинон, пластохинон и витамины группы К.
Перенос по цепи электрона, отнятого от возбужденного хлорофилла, завершается по-разному в зависимости от типа фотосинтеза. У зеленых бактерий, использующих комплекс хлорофилла и белка, называемый фотосистемой 1 (рис. 5, а), продуктом оказывается НАДН, то есть восстановленная форма НАД+. Восстанавливаясь, то есть присоединяя два электрона, НАД+ связывает также один Н+. В дальнейшем образованный таким образом НАДН окисляется, передавая свой водород на различные субстраты биосинтезов.
Что
касается хлорофилла, окисленного цепью, то у зеленых серных бактерий он получит
недостающий электрон от сероводорода (H,S). В результате образуются также элементарная сера и ион Н+.
Белок, окисляющий H2S, расположен на внешней поверхности
бактериальной мембраны, а белок, восстанавливающий НАД+, — на внутренней
ее поверхности. Вот почему оказывается, что запускаемый светом перенос
электронов от H,S к НАД"1" образует
ионы Н+ снаружи и потребляет их внутри бактерии. При этом внутренний
объем клетки заряжается отрицательно относительно внешнего. Тем самым создается
∆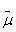 Н+, которая потребляется Н+
- АТФ-синтазой (комплексом факторов F0 и F,),
образующей АТФ при переносе ионов Н "под гору", то есть снаружи
внутрь.
Н+, которая потребляется Н+
- АТФ-синтазой (комплексом факторов F0 и F,),
образующей АТФ при переносе ионов Н "под гору", то есть снаружи
внутрь.
Другой тип бактериального фотосинтеза обнаружен у пурпурных бактерий (рис. 5. б). Здесь действует набор ферментов, отличающихся от ферментного комплекса зеленых бактерий. Это несущая хлорофилл фотосистема 2 и комплекс III. Как и в предыдущем случае, процесс начинается с поглощения кванта хлорофиллом. Первоначатьно перенос электронов происходит по фотосистеме 2.
Затем вступает комплекс III, способный транспортировать электроны сопряженно с откачкой ионов Н+ из бактерии. Процесс завершается возвращением электрона с комплекса III на хлорофилл. Что касается ионов Н+, то они возвращаются в клетку через Н+-АТФ-синтазу, образуя АТФ.
Отличительная черта фотосинтеза у пурпурных бактерий состоит в том, что система не нуждается во внешнем доноре электронов. Откачка ионов Н+ осуществляется путем циклического переноса электронов, поддерживаемого энергией света. Данное обстоятельство можно отнести, по-видимому, на счет эволюционного усовершенствования фотосинтеза пурпурными бактериями, которые по многим признакам являются эволюционно более продвинутой группой, чем зеленые серные бактерии.
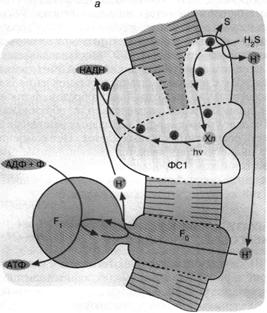
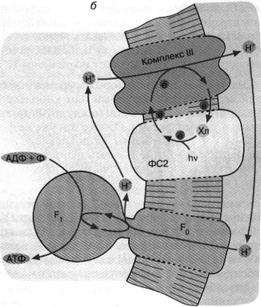
Рис. 5. Хлорофилльный фотосинтез зеленых серных (а) и пурпурных (б) бактерий: а - хлорофилл, связанный с особым белковым комплексом - фотосистемой 1 (ФС1), возбуждается квантом света и отдает электрон по цепи электронных переносчиков на НАД+. Восстанавливаясь, НАД* связывает внутриклеточный ион НГ. Потеря электрона на хлорофилле компенсируется окислением сероводорода до серы и иона ИГ снаружи бактериальной клетки. Движение Н+ внутрь клетки через комплекс F0F1 дает АТФ; б - хлорофилл, связанный с белком фотосистемы 2 (ФС2), поглощает квант света и запускает циклический перенос электронов. В этом процессе участвуют переносчики электронов ФС2 и дополнительного белкового комплекса III. Перенос электронов комплексом III сопряжен с откачкой ионов Н+ из клетки. Откачанные ионы I-Г возвращаются через комплекс F0F, с образованием АТФ
Следующим шагом в эволюции фотосинтеза стали, по-видимому, цианобактерии. Цепь переноса электронов в этом случае представляет собой комбинацию: а) фотосистемы 1 зеленых бактерий, б) фотосистемы 2 и комплекса III пурпурных бактерий и в) дополнительного комплекса, расщепляющего воду на О2 и Н+ (рис. 6). Фактически донором электронов вместо сероводорода (встречающегося в достаточных количествах лишь в некоторых приданных нишах) служит вездесущая вода, запасы которой практически неограниченны. В результате конечный акцептор электоров — НАДФ+ восстанавливается, а вода окисляется. Образующийся НАДФН окисляется затем сложной системой восстановления углекислого газа до глюкозы. Таким образом, фотосинтез цианобактерии параллельно с образованием АТФ дает углевод — одно из главных резервных веществ современных живых клеток. Нет сомнений, что цианобактерия является эволюционным предшественником хлоропластов — органелл зеленых растений, энергетика которых устроена в основном по той же схеме, что показана на рис. 6.
ДЫХАТЕЛЬНЫЙ МЕХАНИЗМ ЭНЕРГООБЕСПЕЧЕНИЯ
Побочным продуктом фотосинтеза у цианобактерий и растений служит молекулярный кислород. Нарастание его концентрации в атмосфере привело к появлению ферментов, убирающих этот сильный окислитель, опасный для жизнедеятельности. Вероятно, первой функцией ферментов, восстанавливающих О2 до Н2О, было снижение внутриклеточной концентрации кислорода. Однако в дальнейшем аэробная клетка научилась извлекать пользу из этого процесса, создав дыхательную цепь электронного транспорта, сопряженного с откачкой ионов Н+.
Дыхательная цепь некоторых современных бактерий включает уже знакомый нам комплекс III, служащий связующим звеном между двумя другими белковыми комплексами. Однако это уже не фотосистемы 1 и 2, а ферменты, выполняющие функции, противоположные таковым фотосистем 1 и 2. Ферменты, о которых идет речь, были названы комплекс I и комплекс IV.
Комплекс I не восстанавливает никотинамидный нуклеотид, а окисляет его. Комплекс IV не окисляет воду до О2, а восстанавливает О2 до воды. В итоге мы имеем сложную цепь реакций, начинающихся с окисления НАДН и кончающихся восстановлением О2. Все три комплекса дыхательной цепи способны откачивать из клетки ионы Н+ сопряжено с переносом электронов (рис. 7).
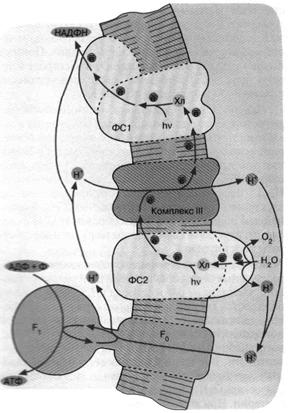
Рис. 6. Хлорофилльный фотосинтез цианобактерии. Квант света, поглощенный хлорофиллом фотосистемы 1, возбуждает перенос электронов по цепи, что завершается восстановлением НАДФ+ до НАДФН. Окисленный хлорофилл фотосистемы 1 восстанавливается комплексом III, который, в свою очередь, получает электрон от фотосистемы 2. Донирование электрона фотосистемой 2 требует еще одного кванта света (поглощаемого хлорофиллом этой фотосистемы). Потеря электрона на хлорофилле фотосистемы 2 компенсируется за счет окисления молекулы воды до О2 и Н+. Ферменты, катализирующие всю цепь реакций переноса электрона от Н2О до НАДФ*, расположены в мембране таким образом, что ионы Н+ откачиваются из бактериальной клетки, чтобы затем войти внутрь через FCF. и сделать АТФ. В хлоро-пластах зеленых растений происходят те же события, но ориентация всех ферментов противоположна той, которая имеет место у цианобактерии и показана на рис. 6. Соответственно у хлоропластов фотосинтетическая цепь накачивает ионы Н+ внутрь, а комплекс F0F, переносит их наружу
Подобно тому как хлоропласты произошли от цианобактерии, митохондрии животных, растений и грибов ведут свое происхождение от аэробных бактерий. Поэтому неудивительно, что митохондриальная дыхательная цепь описывается той же схемой, что изображена на рис. 7.
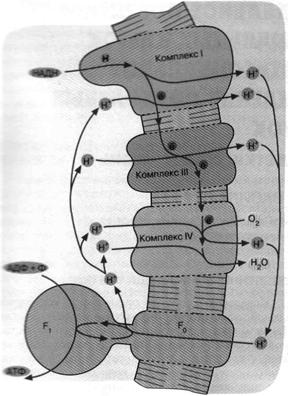
Рис.7. Механизм дыхательного фосфорилирования в аэробных бактериях и митохондриях. Ферментные комплексы I, III и IV катализируют перенос электронов от НАДН к О2 с образованием воды. Перенос электронов сопряжен с откачкой ионов Н*. Возвращение ионов Н+ через F0F1 приводит к синтезу АТФ
ФОТОСИНТЕЗ И БИОСФЕРА
Основным и практически неиссякаемым источником энергии на поверхности Земли является энергия солнечного излучения, постоянным потоком поступающая из космоса благодаря протеканию термоядерных реакций на ближайшем к нам светиле — Солнце. Как показано на рис. 1, спектр поступающего на Землю солнечного излучения соответствует спектру излучения абсолютно черного тела, нагретого до 5900 К. Полный поток солнечного излучения (измеренный за пределами земной атмосферы), приходящийся на единицу поверхности, нормальной к направлению на Солнце, близок к 1400 Вт/м2. Значительная часть этой энергии приходится на область видимого и ближнего инфракрасного излучения (0,3 - 1,0 мкм) — фотосинтетически активную радиацию, эффективно поглощаемую пигментами, участвующими в фотосинтезе растений и фотосинтезирующих бактерий.
Какая бы часть спектра этого излучения ни поглощалась на Земле, это в конечном счете приводит главным образом к нагреванию поверхности планеты и ее атмосферы, или же энергия вновь испускается в космическое пространство. Какова же роль фотосинтеза, фотосинтезирующих организмов в улавливании этой энергии? Почему утверждают, что фотосинтез - это энергетическая основа биологических процессов, энергетический движитель развития биосферы? Почему говорят как о фотоавтотрофии (то есть о питании за счет света) биосферы в целом, так и о фотоавтотрофии человечества, а жизнь на Земле называют космическим явлением прежде всего потому, что она существует и развивается за счет энергии, поступающей к нам из космоса — от ближайшего космического светила?
Как известно, фотосинтез растений заключается в преобразовании и запасании солнечной энергии, в результате которого из простых веществ — углекислоты и воды — синтезируются углеводы и выделяется молекулярный кислород. В общем виде этот процесс можно описать следующим уравнением (рис. 2).
Несмотря на кажущуюся простоту фотосинтеза, на Земле, пожалуй, нет более удивительного процесса, который смог бы в такой степени преобразовать нашу планету.
ЗАПАСАНИЕ ЭНЕРГИИ
Как следует из уравнения (рис. 2), на каждый ассимилированный в процессе фотосинтеза моль углекислоты запасается 114 ккал энергии. В чем же состоит достоинство запасания солнечной энергии растениями по сравнению с неорганизованной ("нефотосинтезирующей") системой? Любое вещество, поглощая квант солнечной энергии, переходит в возбужденное состояние, что уже можно рассматривать как преобразование энергии электромагнитного излучения и ее запасание. Однако энергия электронного возбуждения очень быстро (за 10-13 – 10-11 сек) растрачивается на тепло или жевновь излучается в пространство (для сложных органических молекул типа хлорофилла этот процесс происходит за 10-8 – 10-9 сек) и, следовательно, в виде возбужденных состояний энергия света может быть запасена лишь на незначительные доли секунды. В результате же фотосинтеза энергия поглощенного кванта света (или, лучше сказать, часть этой энергии) запасается надолго: от минут и часов до сотен и даже миллионов лет (как это имело место, например, при образовании горючих ископаемых — нефти, природного газа, каменного угля, торфа в результате разложения наземных и морских растений или животных). Но этим, конечно, не исчерпывается специфика фотосинтеза в использовании солнечной энергии. Так, формирование горных ледников и озер тоже происходит за счет энергии Солнца, идущей на испарение воды, и при этом тоже происходит запасание солнечной энергии на длительное время. В связи с этим говорят об еще одном преимуществе фотосинтеза: запасание солнечной энергии происходит в очень удобной для биологического использования форме - молекулярной, в виде богатых энергией связей, в основном в сахарах и их производных, а также в аминокислотах, белках, жирах, которые в любой необходимый момент могут быть использованы растениями или "съевшими" их нефотосинтезирующими (гетеротрофными) организмами для покрытия своих энергетических потребностей, для биосинтеза собственных высокомолекулярных соединений.

Рис. 1. Интенсивность падающего на Землю солнечного излучения (Нl) в зависимости от длины волны. Заштрихованные области соответствуют ненаблюдаемым на уровне моря участкам спектра из-за их поглощения указанными компонентами атмосферы. 1 - Солнечное излучение за границей атмосферы, 2 - солнечное излучение на уровне моря, 3 - излучение абсолютно черного тела при 5900 К. (Справочник по геофизике и космическому пространству. Под ред. С.Л. Валлея и Мак Гроу-Хилла, Нью-Йорк, 1965).
Фотосинтез
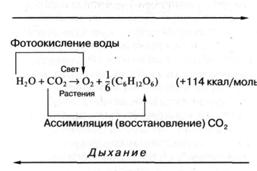
Рис. 2. Уравнение фотосинтеза кислородвыделяющих фотосинтезирующих организмов.
Масштабы фотосинтетического преобразования и запасания солнечной энергии огромны: каждый год за счет фотосинтеза на Земле образуется около 200 млрд. тонн биомассы, что эквивалентно энергии, равной 3 • 1021 Дж или 7,2 • 1020 кал. При этом необходимо иметь в виду, что фотосинтез — единственный биологический процесс, протекающий с запасанием (с увеличением) свободной энергии. Все остальные процессы, как в растениях, так и в животных, проходят за счет химической энергии, накапливаемой в фотосинтезирующих организмах в результате преобразования поглощенного солнечного света. Следовательно, практически вся живая материя на Земле представляет собой прямой или отдаленный результат фотосинтетической деятельности растений, которые являются посредниками между неиссякаемым источником энергии — Солнцем и всем живым миром нашей планеты. Именно поэтому мы говорим о фотоавтотрофии биосферы Земли, в том числе и о фотоавтотрофии человечества. Население Земли ежегодно потребляет около 1 млрд. тонн продуктов питания, что соответствует 15 • 1018 Дж, если считать численность населения равной 5 млрд. человек. Следовательно, человечество потребляет в виде органических веществ лишь около 0,5% всей энергии, запасаемой в результате фотосинтеза. Общее потребление энергии в мировом масштабе составляет 3 — 4 • 1020 Дж в год, то есть около 10% всей энергии, запасаемой за год благодаря фотосинтезу. Разведанные запасы ископаемого топлива (нефти, газа, угля, торфа) по запасенной в них энергии соответствуют продукции фотосинтетической деятельности на Земле приблизительно за 100 лет, что эквивалентно также энергии, которая содержится во всей биомассе, находящейся в настоящее время на нашей планете.
АССИМИЛЯЦИЯ ДВУОКИСИ УГЛЕРОДА
Ежегодная ассимиляция углекислого газа на Земле в результате фотосинтеза составляет около 260 млрд. тонн, что эквивалентно 7,8 • 10'° тонн углерода, и это связывание углерода компенсируется выделением практически такого же количества СО2 в результате дыхания нефотосинтезирующих организмов. Количество СО2, вовлекаемого в цикл "фотосинтез—дыхание", составляет около 10% массы углекислого газа в атмосфере, которая в 1980 году была эквивалентна 7,1 • 10" тонн углерода. В то же время до 1860 года атмосфера содержала лишь 6,1 • 10й тонн углерода в виде СО2, и это 15%-ное увеличение СО2 в атмосфере связывают прежде всего с появлением дополнительного источника СО2вследствие интенсивного сжигания ископаемого топлива, которое эквивалентно в настоящее время 5 • 109 тонн углерода в год и увеличивается в среднем на 4,3% в год.
Необходимо отметить, что значительно большая часть углерода содержится в виде карбонатов в осадочных породах - 5,5 • 1016 тонн, в живых (в основном леса) и отмерших организмах - 3,5 • 1012тонн. В мировом океане содержится в 60 раз больше углерода, чем в атмосфере (3,5 • 1013 тонн), что связано с очень высокой растворимостью СО2 в воде и образованием Н2СО3 и, следовательно, можно было бы предположить, что незначительное дополнительное поступление СО2 в результате сжигания ископаемого топлива, которое составляет менее одного процента в год от содержания углекислого газа в атмосфере, не должно приводить к заметному увеличению содержания СО2 в атмосфере. Однако в действительности лишь в верхних слоях океана, содержащих лишь 1,5% всего углерода, растворенного в воде, обмен углерода с атмосферой осуществляется достаточно быстро (за 6 - 7 лет), тогда как для установления такого равновесия с глубинными слоями океана требуется несколько тысячелетий. Вследствие этого сжигание ископаемого топлива в промышленном масштабе привело к увеличению содержания СО2 в атмосфере с 0,027% (в доиндустриальную эпоху) до 0,034% в настоящее время. Расчеты показывают, что к 2035 году содержание углекислого газа в атмосфере удвоится, то есть будет составлять около 0,06%. Основным последствием этого, как считается, будет глобальное потепление климата, обусловленное так называемым "тепличным эффектом", связанным с тем, что углекислый газ "прозрачен" для основной части солнечного света, но задерживает (поглощает) тепловое (инфракрасное) излучение от нагретой Солнцем поверхности Земли. Увеличение концентрации СО2 в атмосфере в два раза может привести к повышению температуры поверхности Земли на 2 — 3°С, причем оно будет минимальным в тропической зоне и максимальным в высоких широтах (8 - 11°С). Такое повышение температуры вызовет таяние льдов, особенно в Антарктиде, что может привести к повышению уровня моря на 5 м и затоплению значительной части суши. Поэтому возможность глобального потепления климата становится сейчас проблемой всего человечества. Согласно Международной конвенции, принятой в 1992 году, развитые индустриальные страны будут проводить политику ограничения промышленного выброса СО2 в атмосферу, а также защиты и увеличения стоков и резервуаров СО2, то есть растительности. Обсуждается даже вопрос о том, что страны с повышенным выбросом СО2 должны платить компенсацию странам, где потребление С02 превышает его продукцию. В этой связи необходимо отметить, что, согласно оценкам, проведенным российскими учеными, Россию, наряду с северными территориями Канады,но отнести к странам с увеличенным потреблением СО2, что связано главным образом с "отставанием" минерализации органического вещества от фотосинтетической ассимиляции СО2 в условиях переувлажненных почв на фоне невысоких температур в северных областях нашей страны. Интересно отметить мнение академика А.Л. Яншина о том, что для России, более 50% территории которой расположено в зоне вечной мерзлоты, повышение концентрации СО2 и связанное с ним потепление климата выгодно. При этом следует также учитывать, что двукратное повышение содержания СО2 в атмосфере приведет к 60%-ному повышению скорости фотосинтеза на Земле.
ВЫДЕЛЕНИЕ МОЛЕКУЛЯРНОГО КИСЛОРОДА
Приобретенная в процессе эволюции (более 2 млрд. лет назад) способность фотосинтезирующих растений к выделению молекулярного кислорода в результате окисления воды (см. рис. 2) привела к поистине революционным преобразованиям на Земле, из которых необходимо отметить следующие.
1. Фотосинтезирующие организмы, а через их посредство и вся живая природа, получили доступ к практически неиссякаемому и возобновляемому источнику электронов, участвующих во всех биоэнергетических процессах, — воде, что, естественно, привело к резкому возрастанию масштабов фотосинтеза и поступления энергии в биосферу. Ранее фотоокислению могли подвергаться лишь восстановленные вещества типа H2S, представленные на Земле в довольно ограниченном количестве.
2. Продукт фотосинтетического окисления воды — молекулярный кислород, содержание которого в атмосфере возросло в результате фотосинтеза практически от нуля в древней атмосфере до 21% в настоящее время, вызвал значительные изменения во всей живой природе. Появление в атмосфере свободного О2 привело к массовой гибели существовавших тогда организмов, для которых такой сильный окислитель как кислород оказался сильнейшим ядом, поскольку он резко нарушал протекание биоэнергетических процессов. В то же время в результате длительной эволюции на фоне возрастающей концентрации О2 в атмосфере появились новые, аэробные организмы, обратившие наличие О2 себе на пользу. Они сумели включить его в свой метаболизм в качестве эффективного конечного акцептора электронов в дыхательной цепи. Это позволило поднять биоэнергетику на новый, значительно более высокий уровень, так как в этом случае происходит более эффективное "сжигание" органики. Так, например, выход макроэргического эквивалента — аденозинтрифосфата (АТФ) на одну молекулу исходной гексозы составляет две молекулы при молочнокислом брожении и 36 — 38 молекул (то есть в 18—19 раз выше) при аэробном дыхании.
Фотосинтетическое образование О2, сопровождающееся поглощением СО2, в сочетании с появившейся возможностью аэробного дыхания, при котором происходит обратный процесс — потребление 02, сопровождающееся освобождением СО2, привело к образованию замкнутых циклов О2 и СО2, имеющих глобальные масштабы. Сочетание этих циклов позволяет восполнять содержание как СО2, так и О2, а их участие в едином цикле "фотосинтез-дыхание" обеспечивает постоянное поступление энергии в биосферу (см. рис. 2).
3. Появление кислородвыделяющих организмов привело к тому, что практически все процессы на поверхности Земли приняли биогеохимический характер. Именно в этот период значительного повышения О2 в атмосфере произошло окисление соединений железа, серы, марганца, причем на это ушло более 95% кислорода, выделенного фотосинтезирующими организмами за всю историю биосферы. Атмосфера Земли до появления кислородвыделяющих фотосинтезирующих организмов была разреженной и состояла главным образом из СО2 и аммиака. По мере возрастания О2 в атмосфере значительно увеличивается и содержание молекулярного азота благодаря окислению аммиака. Сам процесс фотосинтеза, сопровождающийся образованием и запасанием органического вещества, привел к значительному, более чем в 100 раз, уменьшению содержания СО2 в атмосфере.
В результате первичная разреженная атмосфера превратилась во вторичную плотную азотокислородную оболочку Земли. Теперь солнечная и другие виды космической радиации, прежде чем достичь поверхности, должны были фильтроваться через мощный слой атмосферы. Кроме того, под действием фотохимического процесса в верхних слоях атмосферы двухатомный молекулярный кислород превращается в трехатомную молекулу озона, имеющего интенсивное поглощение в области жесткого ультрафиолета (0,2 — 0,3 мкм). В результате образовавшийся озоновый экран стал задерживать наиболее опасную для живых организмов ультрафиолетовую радиацию.
Таким образом, фотосинтез, основанный на окислении воды, благодаря возможности использовать воду в качестве субстрата стал мощным поставщиком энергии в биосферу, революционным образом обогатил биоэнергетику благодаря включению О2 в метаболизм живых организмов, защитил живую материю от гибельного действия космической радиации. Все это индуцировало мощное развитие биологической материи на Земле, приведшее в конечном счете к появлению человека. И в настоящее время фотосинтез лежит в основе биологического круговорота энергии и веществ на Земле, от масштабов которого зависит и жизнь на нашей планете, и ее разнообразие и возможности.
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ПРЕОБРАЗОВАНИЯ И ЗАПАСАНИЯ ЭНЕРГИИ СВЕТА ПРИ ФОТОСИНТЕЗЕ
Живая природа настолько рационально решает проблемы эффективного улавливания солнечной энергии, ее преобразования и запасания в удобной для биологического потребления форме, что до сих пор не удается воспроизвести основные этапы фотосинтеза в искусственных системах. Первичное улавливание и преобразование энергии света при фотосинтезе происходит с непременным участием хлорофилла, что было выявлено уже в классических работах К.А. Тимирязева, показавшего, что именно та часть солнечного света, которая поглощается хлорофиллом, эффективно инициирует процесс фотосинтеза.
Как показано на рис. 3а, молекула хлорофилла состоит из порфиринового ядра, образованного тетрапиррольным кольцом с расположенным в центре атомом магния, и фитольного хвоста. Хлорофилл относится к классу веществ, называемых пигментами, то есть сильноокрашенных соединений, характеризующихся интенсивным поглощением видимого света. Было установлено, что система "легко возбудимых" сопряженных связей порфиринового кольца обусловливает высокую способность хлорофилла к поглощению света (рис. 36). Так, миллиметровый слой 1 мМ раствора хлорофилла поглощает около 90% падающего на него красного или синего света (зеленый свет поглощается менее эффективно, что и определяет зеленый цвет растений). Для хлорофилла, как и для других пигментов, характерно относительно длительное время, около 1(Г8 сек, нахождения в возбужденном состоянии, что важно для участия хлорофилла в фотохимических реакциях. У многих других пигментов, например, у производных хлорофилла, у которых центральный атом магния заменен на медь или марганец, это время гораздо ниже вследствие чрезвычайно быстрого перехода энергии электронного возбуждения в тепло.
Для выяснения молекулярных основ участия хлорофилла в первичных процессах преобразования солнечной энергии при фотосинтезе важнейшее значение имело открытие, сделанное нашим соотечественником, академиком А.А. Красновским, который показал, что при переходе в возбужденное состояние в результате поглощения кванта света молекула хлорофилла приобретает свойство вступать в такие окислительно-восстановительные (то есть идущие с переносом электронов) реакции, к которым она не была способна в темноте. При этом молекула хлорофилла (Хл) может потерять свой электрон, то есть окислиться, отдав его другому веществу, называемому в данном случае акцептором (А) электрона, тогда как хлорофилл выступает в данной реакции как донор электрона. Эта реакция получила название реакции Красновского. Возбужденная молекула хлорофилла (Хл*) может также восстанавливаться, то есть принять "лишний" электрон, отобрав его у другого вещества, служащего в данном случае донором (Д) электрона. Если помимо Хл в системе присутствуют Д и А, то в результате сочетания процессов окисления Хл и его восстановления свет, поглощаемый хлорофиллом, будет индуцировать перенос электрона от Д к А с образованием Д+ (окисленного Д) и А- (восстановленного А). Хлорофилл при этом, несмотря на участие в двух ступенях переноса электрона, возвращается в исходное состояние готовности к новому фотохимическому циклу переноса электрона, согласно реакции
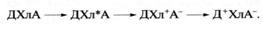
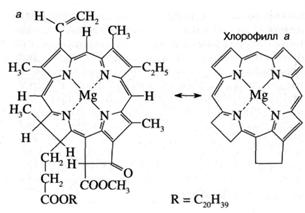
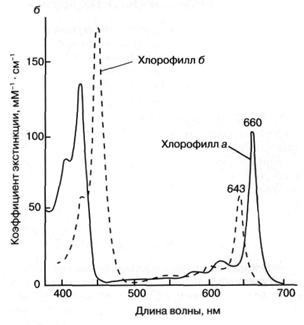
Рис. 3. Структурная химическая формула (а) и спектр поглощения (зависимость поглощения от длины волны) (б) хлорофилла.
В результате получается система с разделенны-мрядами Д+ХлА- (элементарная электрическая баторейка), в которой может быть запасена значительная часть энергии кванта света, поглощенного хлорофиллом. Как показано в работах последних десятилетий, именно этот принцип — фоторазделения зарядов — лежит в основе первичного преобразования энергии света при фотосинтезе.
Как показано на рис. 4, хлорофилл, определяющий зеленый цвет листа растения, распределен не по всей растительной клетке, а сосредоточен в пластидах, называемых хлоропластами. В хлоропластах сосредоточен фотосинтетический аппарат, и их роль состоит в энергообеспечении клетки за счет поглощенного света. Хлоропласт имеет геном, который делится при делении хлоропласта. Несмотряна наличие собственного генома, обеспечивающего синтез большей части структур фотосинтетического аппарата, ряд строго необходимых для протекания фотосинтеза компонентов (например, основные ферменты, участвующие в биосинтезе хлорофилла, некоторые белки, входящие в систему фотосинтетического окисления воды), кодируются в клеточном геноме. Хлоропласт заполнен так называемыми тилакоидами - замкнутыми сплющенными "мешочками", которые состоят из двухслойных липидных мембран, образованных в результате впячивания внутреннего слоя двухслойной мембраны, ограничивающей весь хлоропласт от цитоплазмы. Тилакоиды сгруппированы в плотно упакованные темно-зеленые "стопки", получившие название гран, которые связаны между собой частью тилакоидов. В мембраны тилакоидов погружены белки или белковые комплексы, большая часть которых насквозь пронизывает мембрану. Только часть из этих комплексов окрашена в зеленый цвет, то есть содержит хлорофилл; было установлено, что практически весь хлорофилл находится в хлорофилл-белковых комплексах, или, лучше сказать, в пигмент-белковых комплексах, поскольку все они наряду с хлорофиллом содержат другие пигменты.
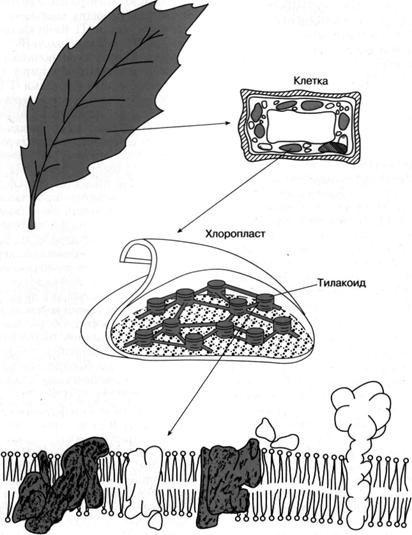
Мембрана тилакоида Рис. 4. Локализация фотосинтетического аппарата в клетке зеленого растения.
Пигмент-белковые комплексы можно разделить на две функциональные группы. Основная функция первой из них — "светособирающих" или "антенных" пигмент-белковых комплексов - состоит в эффективном улавливании энергии света. Более 90% всего хлорофилла сосредоточено именно в "антенных" комплексах. Большая их часть представляет собой белки с молекулярной массой от 20000 до 70000, на каждом из которых расположены 10 - 40 молекул хлорофилла. Помимо основного пигмента — хлорофилла а — в состав этих комплексов входит его аналог — хлорофилл б, а также каротиноиды — пигменты желтого или оранжевого цвета (один из них, бета-каротин, определяет окраску моркови). Цианобактерии содержат также бесхлорофилльные пигмент-белковые комплексы - фикобилины, окрашенные в синий или красный цвет. Они эффективно поглощают свет в области спектра, где хлорофилл имеет слабое поглощение, что позволяет осуществить более эффективное улавливание солнечной энергии.
Энергия возбуждения от светособирающих пигментов с очень высокой эффективностью (близкой к 100%) передается на хлорофилл другой группы пигмент-белковых комплексов - фотохимические реакционные центры. Их основная и важнейшая для всей биосферы функция состоит в том, чтобы преобразовать энергию электронного возбуждения хлорофилла (полученную в результате поглощения света в данном комплексе или в результате миграции возбуждения от светособирающих комплексов) в энергию разделенных зарядов, подобно тому, как это происходит в реакции Красновского, описанной выше.
У кислородвыделяющих организмов имеется два типа реакционных центров, функционирующих в так называемых фотосистеме 1 (ФС-1) и фотосистеме 2 (ФС-2) (рис. 5). Аналоги каждого из этих реакционных центров обнаружены у ряда фотосинте-зируюших бактерий, и молекулярная структура одного из них, выделенного из пурпурной бактерии Rhodopseudomonasviridis, впервые была установлена с помощью рентгеноструктурного анализа. Необходимо отметить, что значительная часть знаний о структурной и функциональной организации фотосинтетических реакционных центров получена при помощи изучения именно бактериальных реакционных центров. Они отличаются высокой стабильностью в изолированном из мембраны состоянии, и именно из них удалось впервые получить
кристаллы, использование которых в рентгено-структурных исследованиях позволило получить данные о молекулярной структуре реакционного центра. За эту работу группа немецких исследователей в 1988 году получила Нобелевскую премию.
Бактериальный реакционный центр состоит из трех полипептидов с молекулярной массой от 24000 до 32000, на которых расположены молекулы одного из представителей хлорофиллов - бактериохлорофилла (Бхл) и две молекулы его безмагниевого производного — бактериофеофитина (Бфф). Две из четырех молекул Бхл расположены настолько близко друг к другу (около 3 Å), что формируют компактное образование — димер (П), а четыре другие одиночные молекулы пигментов образуют две симметричные по отношению к П цепочки Бхл—Бфф. Энергия электронного возбуждения, полученная в результате поглощения света пигментами самого реакционного центра или в результате ее миграции от светособирающих комплексов, локализуется в конечном счете на П. Возбужденный П, обозначаемый как П*, за время около 10-12 сек передает свой электрон на одну из одиночных молекул пигмента, так что в результате образуется первичное состояние с разделенными зарядами П+Бфф-. Это состояние обладает очень коротким временем жизни (около 10~8 сек) вследствие возможного возврата электрона от Бфео- к П+. Однако вероятность этого процесса очень низка благодаря более быстрому (2 • 10-10 сек) "прямому" переносу от Бфео- к "стабильному" акцептору электрона, получившему название Q. При этом образуется состояние П+БфеоQ-, время жизни которого уже составляет около 10-3 сек. Необходимо отметить очень высокую эффективность описанных стадий фоторазделения зарядов. Так, квантовая эффективность, то есть доля поглощенных квантов, вызвавших перенос электрона, близка к 100%. Энергетическая эффективность, то есть доля энергии возбуждения, запасенной в результате фотохимического акта, составляет свыше 90% для первой стадии переноса электрона и около 50 - 70% для второй. Об изумительном совершенстве этой уникальной биологической "машины" свидетельствует, например, тот факт, что с такой же эффективностью фотоперенос электрона в реакционном центре осуществляется даже при температуре жидкого гелия (-271°С).
Основным итогом фотохимической стадии преобразования энергии света у кислородвыделяющих фотосинтезируюших организмов является фотоперенос электронов от воды к НАДФ+. Обе фотосистемы (ФС-1 и ФС-2) участвуют в этом процессе, обеспечивая двухступенчатое поступление энергии для его протекания. ФС-2 осуществляет окисление воды с образованием молекулярного кислорода, согласно реакции: 2Н20 + 4hv—О2 + 4е+ 4Н+, где hvобозначает квант света, е—электрон. В результате фотохимического акта реакционного центра ФС-2 образуется самый сильный биологический окислитель — окисленный хлорофилл, который окисляет воду с участием марганецсодержащей энзиматической системы. Электроны, оторванные от воды, через цепь темновых реакций поступают на ФС-1, использующую их для фотовосстановления НАДФ+ до НАДФН, которое тоже осуществляется с участием специальной энзиматической системы. Окисление воды, а также перенос электронов от ФС-2 к ФС-1 приводит к появлению разности концент-
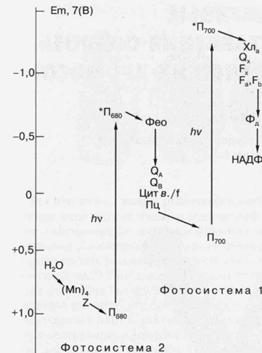
Рис. 5. Схематическое изображение фотосинтетической цепи переноса электрона в хлоропласах растений и цианобактерий. (Мп)4 - Комплекс из четырех атомов Мп, связанных с белками реакционного центра фотосистемы 2 (ФС-2); Z - вторичный донор электрона ФС-2, (остаток тирозина); Пбао - первичный донор электрона ФС-2 (димер хлорофилла); *П680 - возбужденное состояние хлорофилла П680; Фео - первичный акцептор электрона ФС-2, феофитин; QA и QB -акцепторы электрона хиноновой природы; цит в./f-комплекс цитохромов, участвующих в переносе электрона от ФС-2 к фотосистеме 1 (ФС-1); Пц - пластоцианин (подвижный переносчик электрона); П700 - первичный донор электрона ФС-1 (димер хлорофилла); *П700 - возбужденное состояние П700;Хла-(хлорофилл) и Ох-(хинон), соответственно, первичный и вторичный акцепторы электрона ФС-1; Fx, Fa и Fb акцепторы электрона ФС-1 (Fe-S-центры); Фд - ферредоксинрастворимый переносчик электрона (Fe-S-содержащий белок); НАДФ+ - никотинамидаденин динуклеотид фосфат (конечный переносчик электронов, используемый вместе с АТФ в ассимиляции СО2), hv - квант света. По вертикальной шкале указаны приблизительные значения окислительно-восстановительных потенциалов переносчиков электрона при рН 7.
раций ионов Н+ по обе стороны тилакоидной мембраны, которая, как и в случае митохондрий, необходима для осуществления процесса фосфо-рилирования — образования АТФ, основного энергетического эквивалента, используемого в качестве источника энергии в биологических процессах. Образованные в результате фотохимического переноса электронов АТФ и НАДФН используются для восстановления СО2 с образованием первичных са-харов, которое в упрощенном виде можно описать следующим образом: СО2 + 4е + 4Н+ —*• СН2О + + Н2О. При этом на каждую молекулу СО2 расходуется две молекулы НАДФН и три молекулы АТФ. Этот процесс, в результате которого "восстановленная" молекула СО2 включается в состав гексозы, осуществляется через ряд стадий с участием сложного цикла энзиматических реакций, получившего название цикла Кальвина по имени его открывателя. В заключение необходимо отметить, что исследование фотосинтеза — сложнейшего фундаментального биологического процесса, имеющее давние традиции в отечественной науке, привлекает в настоящее время внимание все большего числа естествоиспытателей — биологов, физиков, химиков, математиков. Познание молекулярных механизмов фотосинтеза будет иметь большое значение для обеспечения человечества экологически чистой энергией за счет практически неиссякаемого источника — солнечного излучения (например, на основе фоторазложения воды на молекулярной водород и кислород), для повышения фотосинтетической продуктивности растений, лежащей в основе обеспечения человечества пищей, для использования принципов фотопреобразования световой энергии при фотосинтезе в фотобиотехнологических и фотобиотехнических системах, для обеспечения длительных космических экспедиций органикой и молекулярным кислородом, для решения проблем экологической безопасности отдельных регионов, для сохранения и развития биосферы.
ЗАКЛЮЧЕНИЕ
Знания, накопленные при изучении современных организмов различной степени сложности, позволяют сформулировать непротиворечивую концепцию эволюции биоэнергетических систем. Эта концепция дает ключ к пониманию не только путей становления механизмов превращения энергии в клетке, но и позволяет объяснить, почему химия и физика живой клетки базируются на двух основных классах веществ: а) нуклеиновых кислотах и нуклео-тидах и б) белках. Вкратце система взглядов, о которой идет речь, может быть суммирована следующей схемой эволюции жизни.
1. Образование азотистых оснований (пуринов и пиримидинов), а затем и нуклеотидов из Н2О, NH3, СО2, HCN и некоторых других простейших соединений под действием ультрафиолетового излучения Солнца.
2. Использование остатков аденина, а затем также других пуринов и пиримидинов в нуклеотидах для поглощения ультрафиолетового света. При
этом энергия ультрафиолетовых квантов оказывается движущей силой для синтеза АТФ из АДФ и фосфата или для осуществления других энергоемких реакций коферментами-нуклеотидами (адени-новый фотосинтез).
3. Образование резервных веществ за счет энергии АТФ (гликогенез) с тем, чтобы их последующее расщепление могло поддержать ресинтез АТФ при отсутствии ультрафиолетового света (гликолиз).
4. Изменение спектральных свойств атмосферы, ставшей плохо проницаемой для ультрафиолета, и замена "аденинового" фотосинтеза на фотосинтез, использующий видимый свет. В качестве пигментов используется ретиналь, а затем хлорофилл. В результате АТФ, бывший до того как преобразователем световой энергии, так и "конвертируемой энергетической валютой", утрачивает первую из этих двух функций, сохранив только вторую.
5. Увеличение концентрации О2 в атмосфере в результате деятельности фотосинтезирующих организмов и появление ферментов, поглощающих кислород с целью его детоксикации.
6. Создание современных дыхательных систем, преобразующих в АТФ энергию окисления субстратов кислородом.
СПИСОК ЛИТЕРАТУРЫ:
1. Будыко М.И., РоновА.Б., Яншин А.Л. История атмосферы. Л.: Гидрометеоиздат, 1985.
2. Мак-Ивен М., Филяипс Л. Химия атмосферы. М.: Мир, 1978.
3. Фотосинтез / Под ред. Говинжи. М.: Мир. Т. 1 и 2. 1987.
4. Холя Д., Рао К. Фотосинтез. М.: Мир, 1983.
5. Клейтон Р. Фотосинтез. Физические механизмы и химические модели. М.: Мир, 1984.
6. Шувалов В.А. Первичное преобразование световой энергии при фотосинтезе. М.: Наука, 1990.
7. Уайт А., Хендяер Ф.. Смит Р. и др. Основы биохимии. М.: Мир, 1981.
8. Саган К. В. V Происхождение предбиологических систем/Подрех А.И. Опарина. М.: Мир, 1966. С. 211.
9. Понамперума С.В. // Там же. С. 224.
10. Ску.шчев В.П. Аккумуляция энергии в клетке. М.: Наука, 1969.
11. Скулачев В.П. Мембранные преобразователи энергии. М.: Высш. шк., 1989.
12. Ску.ючев В.П. Энергетика биологических мембран. М.: Наука, 1989.
13. Скулачев В.П. Кислород в живой клетке: добро и зло // Соросовский Образовательный Журнал. 1996. № 3. С. 4-16.
14. Скулачев В.П. Законы биоэнергетики //Там же. 1997. № 1. С. 9-14.