Cложные эфиры
| Загрузить архив: | |
| Файл: ref-14921.zip (177kb [zip], Скачиваний: 492) скачать |
Содержание стр.
Введение -3-
1. Строение -4-
2. Номенклатура и изомерия -6-
3. Физические свойства и нахождение в природе -7-
4. Химические свойства -8-
5. Получение -9-
6. Применение -10-
6.1 Применение сложных эфиров неорганических кислот -10-
6.2 Применение сложных эфиров органических кислот -12-
Заключение -14-
Использованные источники информации -15-
Приложение -16-
Введение
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
1. Строение
Общая формула сложных эфиров карбоновых кислот:

где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:
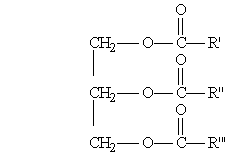
где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная кислота СН3 — (CH2)2 — СООН
2. Капроновая кислота СН3 — (CH2)4 — СООН
3. Пальмитиновая кислота СН3 — (CH2)14 — СООН
4. Стеариновая кислота СН3 — (CH2)16 — СООН
Алкеновые кислоты
5. Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая кислотаС17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая кислота С17Н29СООН
СН3СН2СН = CHCH2CH == CHCH2CH = СН(СН2)4СООН
2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например:

Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химические свойства
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:

Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:

2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:

4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:


5. Получение
1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).


Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:

3. Взаимодействием галоидангидридов кислот со спиртами:

6. Применение
6.1 Применение сложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки):
 Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят
применение в качестве связующих, выдерживающих довольно высокую температуру, в
частности для покрытия поверхности форм для точной отливки металла.
Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят
применение в качестве связующих, выдерживающих довольно высокую температуру, в
частности для покрытия поверхности форм для точной отливки металла.
Аналогично SiCl4реагируют диалкилдихлорсиланы, например ((СН3)2SiCl2, образуя диалкоксильные производные:

Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:

Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:

Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости.
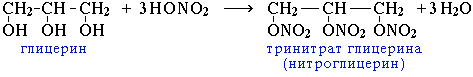
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3ONO2, (т. кип. 60° С) и этилнитрат C2H5ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.

Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(CH2ONO2)4, получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:

Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.
6.2 Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3СООСН3. Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3.
Получают методом этерификации на лесохимических предприятиях при переработке
синтетической и лесохимической уксусной кислоты, гидролизного и синтетического
этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс
получения этилацетата на основе метилового спирта.
Этилацетат подобно ацетону растворяет
большинство полимеров. По сравнению с ацетоном его преимущество в более высокой
температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта
повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно
ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетат.
Амилацетат CH3COOCH2CH2CH2CH2CH3, т. кип. 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат CH2=CHOOCCH3, образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот.Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:

Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17H35COONa→Ca(C17H35COO)2↓ + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Заключение
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Использованные источники информации
1.Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2.Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3.Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
4.
5.
Приложение
Физико-химические свойства сложных эфиров
|
Название |
Давление пара при 20°С, кПа |
Молеку- лярная масса |
Темпера- тура кипения при 101,325 кПа. °С |
Плотность при 20°С. г/см3 |
Показа- тель перелом- ления n20 |
Поверхнос- тное натяжение 20°С. мН/м |
|
Метилацетат |
23,19 |
74,078 |
56,324 |
0,9390 |
1,36193 |
24,7625,7 |
|
Этилацетат |
9,86 |
88,104 |
77,114 |
0,90063 |
1,37239 |
23,75 |
|
Пропилацетат |
3,41 |
102,13 |
101,548 |
0,8867 |
1,38442 |
20,53 |
|
Изопропилацетат |
8,40 |
102,13 |
88,2 |
0,8718 |
1,37730 |
22,1022 |
|
Бутилацетат |
2,40 |
116,156 |
126,114 |
0,8813 |
1,39406 |
25,2 |
|
Изоиутилацетат |
1,71 |
116,156 |
118 |
0,8745 |
1,39018 |
23,7 |
|
Втор-Бутилацетат |
- |
116,156 |
112,34 |
0,8720 |
1,38941 |
23,3322,1 |
|
Гексилацетат |
- |
114,21 |
169 |
0,890 |
- |
- |
|
Амилацетат |
2,09 |
130,182 |
149,2 |
0,8753 |
1,40228 |
25,8 |
|
Изоамилацетат |
0,73 |
130,182 |
142 |
0,8719 |
1,40535 |
24,6221,1 |
|
Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) |
0,49 |
118,0 |
144,5 |
1,007 |
1,4019 |
- |
|
Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) |
0,17 |
132,16 |
156,4 |
0,9748 |
1,4030 |
- |
|
Этиленгликольмоноацетат |
- |
104 |
181-182 |
1,108-1,109 |
- |
- |
|
Этиленгликольдиацетат |
0,05 |
146 |
186-190 |
1,106 |
- |
- |
|
Циклогексилацетат |
0,97 |
142 |
175 |
0,964 |
1,4385 |
- |
|
Этиллактат |
0,13 |
118,13 |
154,5 |
1,031 |
1,4118 |
28,917,3 |
|
Бутиллактат |
0,05 |
146,0 |
185 |
0,97 |
- |
- |
|
Пропиленкарбонат |
- |
102,088 |
241,7 |
1,206 |
1,4189 |
- |