Прогнозирование масштабов заражения АХОВ при химической аварии
| Загрузить архив: | |
| Файл: ref-22003.zip (51kb [zip], Скачиваний: 134) скачать |
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
РОССИЙСКОЙ ФЕДЕРАЦИИ
НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ
АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ

Кафедра гражданской обороны
Расчетно-графическая работа
Тема: "Прогнозирование масштабов
заражения АХОВ при химической
аварии".
Вариант 2/8
 |
Выполнил:
Преподаватель:
Дрягин С.С.
гр. ЭС-22
Ластовкин В.Ф.
Нижний Новгород
Введение. PAGEREF _Toc133728120 h 3
Характеристика АХОВ – аммиака. PAGEREF _Toc133728121 h 4
Прогнозирование масштабов заражения аммиака при химической аварии. PAGEREF _Toc133728122 h 6
Защита населения от аварийно химически-опасного вещества – аммиака. PAGEREF _Toc133728123 h 9
Заключение. PAGEREF _Toc133728124 h 13
Список литературы.. PAGEREF _Toc133728125 h 14
Введение
Проблема промышленной безопасности значительно обострилась с появлением крупномасштабных химических производств в первой половине нашего века. Основу химической промышленности составили производства непрерывного цикла, производительность которых не имеет, по существу, естественных ограничений. Постоянный рост производительности обусловлен значительными экономическими преимуществами крупных установок. Как следствие, возрастает содержание опасных веществ в технологических аппаратах, что сопровождается возникновением опасностей катастрофических пожаров, взрывов, токсических выбросов и других разрушительных явлений.
Безопасность функционирования химически опасных веществ (ХОВ) зависит от многих факторов: физико-химических свойств сырья, полупродуктов и продуктов, от характера технологического процесса, от конструкции и надежности оборудования, условий хранения и транспортирования химических веществ, состояния контрольно-измерительных приборов и средств автоматизации, эффективности средств противоаварийной защиты и т.д.
Характеристика АХОВ – аммиака
Аммиак – бесцветный газ с резким запахом, температура плавления равна –78°С, температура кипения –33°С, хорошо растворяется в воде, спирте и ряде других органических растворителей, аммиак легче воздуха почти в два раза Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке, содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков. На некоторых планетах Солнечной системы ситуация иная: астрономы считают, что значительная часть масс Юпитера и Сатурна приходится на твердый аммиак.
Впервые аммиак был получен в чистом виде в 1774 английским химиком . Он нагревал нашатырь (хлорид аммония) с гашеной известью (гидроксид кальция). Реакцию 2NH4Cl + Ca(OH)2 → NH3 + CaCl2 до сих пор используют в лабораториях, если требуется получить небольшие количества этого газа; другой удобный способ получения аммиака – гидролиз нитрида магния: Mg3N2 + 6H2O → 2NH3 + 3Mg(OH)2.
Аммиак – бесцветный газ, который легко сжижается при охлаждении до
–33,3°С или при комнатной температуре при повышении давления примерно до 10
атм. Замерзает аммиак при охлаждении до –77,7°С. Молекула NH3 имеет
форму трехгранной пирамиды с атомом азота в вершине. Однако, в отличие от
пирамиды, склеенной, к примеру, из бумаги, молекула NH3 с легкостью "вывертывается
наизнанку", наподобие зонтика, и при комнатной температуре она проделывает
такое превращение с огромной частотой – почти 24 млрд. раз в секунду.
Аммиак химически довольно активен и вступает во взаимодействие со многими веществами. В чистом кислороде он сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Смеси аммиака с воздухом при его содержании от 15 до 28% взрывоопасны. В присутствии катализаторов реакция с кислородом приводит к оксидам азота. При растворении аммиака в воде образуется щелочной раствор, который иногда называют гидроксидом аммония. Однако это название не вполне точное, поскольку в растворе сначала образуется гидрат NH3·H2O, который затем частично распадается на ионы NH4+ и OH–. Условно NH4OH считают слабым основанием, при расчете его степени диссоциации предполагается, что весь аммиак в растворе находится в виде NH4OH, а не в виде гидрата.
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, нейлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу . В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Прогнозирование масштабов заражения аммиака при химической аварии.
1. Расчет продолжительности испарения АХОВ:
 час,
час,
где В – толщина слоя разлившихся АХОВ;
Рв – плотность АХОВ, т/м3;
К2 – коэффициент, зависящий от физико-химических свойств;
К4 – коэффициент, рассчитывающий скорость ветра;
К7 – коэффициент, учитывающий температуру воздуха.
 ч
ч
2. Расчет количества АХОВ в первичном облаке:
 т,
т,
где К1 – коэффициент, определяющий условия хранения вещества;
К3 – коэффициент, равный отношению пороговой токсодозы аммиака к пороговой токсодозе данного вещества;
К5 – коэффициент вертикальной устойчивости воздуха;
М0 – количество аварийного вещества, т.
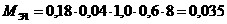 т
т
3. Расчет количества АХОВ во вторичном облаке:
 т,
т,
где К6 – коэффициент, зависящий от времени испарения вещества,
К6 = ТИ0,8
К6 = 1,3620,8 = 1,28
 т
т
4. Расчет глубины зоны заражения первичным и вторичным облаком, Г1 и Г2:
для нахождения Г1 и Г2 делаем интерполяцию по количеству АХОВ в первичном и вторичном облаке соответственно и по скорости ветра:
для Г1:
|
Мэ1 |
Скорость
ветра |
|
0,01 |
0,38 |
|
0,035 |
Х |
|
0,05 |
0,85 |
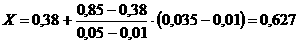
т.е. Г1 =
для Г2:
|
Мэ2 |
Скорость ветра 1 м/с |
|
0,10 |
1,25 |
|
0,247 |
Х |
|
0,50 |
3,16 |

т.е. Г2 =
5. Расчет полной глубины зоны заражения, Гт:
 км
км
 км
км
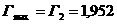 км
км
 км
км
6. Расчет предельно-возможной глубины зоны заражения, Гп:
 км,
км,
где Сп – скорость переноса облака ветром, км/ч;
 км
км
7. Определение окончательной глубины зоны заражения:
за окончательную глубину принимаем меньшую из Гт или Гп:
 км
км
8. Определение формы площади зоны заражения:
если Vв = 0,5 м/с или меньше, то получаем форму круга,
если Vв = 1 м/с – получаем форму полукруга,
если Vв = 2 м/с – сектор с углом 90°.
9. Расчет зоны площади заражения, SЗХЗ:
 км2
км2
где φ° – угловые размеры зоны заражения.
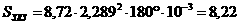 км2
км2
10. Расчет времени подхода облака к заданному объекту, tпод:
 час
час
 час
час

Схема зоны химического заражения
Защита населения от аварийно химически-опасного вещества – аммиака
Вследствие производственных аварий или стихийных бедствий на объектах промышленного производства из резервуаров, трубопроводов или цистерн может произойти выброс (разлив) аммиака в виде газа или жидкости в окружающую среду. Жидкий аммиак быстро вскипает. Образуется облако заражённого воздуха с высокой концентрацией паров, которое распространяется по направлению ветра. В результате возникает зона химического заражения (ЗХЗ) включающая территорию, подвергшуюся непосредственному воздействию аммиака, и территорию, над которой распространяются его пары в поражающих концентрациях.
Признаки поражения аммиаком: насморк, кашель, раздражение и жжение слизистых оболочек, покраснение и зуд кожи, резь в глазах и слезотечение, затруднённое дыхание, удушье, сердцебиение. При соприкосновении жидкого аммиака и его растворов с кожей возможен ожог с образованием пузырей и изъязвлений. В лёгких случаях отравления наблюдается лёгкое раздражение глаз и слизистой носа, чихание, сухость и першение в горле, охриплость голоса, слюнотечение, лёгкая тошнота, головная боль, покраснение лица, потливость, боль в груди. При отравлении средней степени тяжести появляется жгучая боль в горле, сильный кашель, чувство удушья. Возможно развитие отёка гортани. При тяжелых поражениях отмечаются ожоги глаз, кожных покровов, сильное возбуждение, головокружение, тошнота, боли в желудке, рвота, координаторные нарушения, спазм голосовой щели, удушье, возможен бред, задержка мочи, потеря сознания, судороги и смертельный исход (из-за сердечной слабости или остановки дыхания). Летальный исход чаще наступает через несколько часов или дней в результате развившегося отека гортани или лёгких.
При возгорании аммиака и пожаре используют средства пожаротушения: инертные
газы, углекислотные огнетушители (при опасности поражения электрическим током),
воздушно-механическую пену, пожарную машину, мотопомпупрогнозирование зон поражения
по конкретной обстановке; оповещение об опасности поражения работающих на данном
объекте и близко расположенного жилого сектора (в радиусе
Главным поражающим фактором при авариях на химически опасных объектах с выбросом (разливом) аммиака является заражение воздуха, приводящее к поражению людей, находящихся в зоне химического заражения.
Для защиты от паров аммиака эффективны промышленные фильтрующие противогазы марки "К" и "М", при смеси аммиака с сероводородом - марки "ВК".
Чаще используются промышленные противогазы марки "КД" (коробка окрашена в серый цвет) и "КД 8". При отсутствии точных данных о концентрации аммиака время защитного действия противогазов "КД" не должно быть более 120 мин. При отсутствии в воздухе органических веществ можно использовать противогазы марки "М" с защитным временем 90 минут. Для защиты кожных покровов следует использовать защитные прорезиненные костюмы, резиновые сапоги и перчатки.
В качестве подручных средств защиты применяют полотенце или марлю, смоченные 5% раствором лимонной кислоты (столовым уксусом или слабым раствором соляной кислоты).
При организации защиты населения нужно учитывать, что аммиак хоть и легче воздуха, при разливе или утечке, увлажняясь, образует холодный аэрозоль, который распространяется по оврагам, канавам и ложбинам, причём такое движение может не совпадать с основным направлением ветра. Население не должно выходить на улицу. Нужно подняться как можно выше и закрыть окна, перекрыть вентиляционные устройства. Следует иметь в виду, что концентрация аммиака в закрытом помещении, при прохождении аэрозольного облака, во много раз ниже чем в самом облаке, а время существования облака обычно невелико.
Порядок оказания медицинской помощи в очаге поражения аммиаком: в течение первого часа с момента аварии, в очаге химического поражения и в зоне химического заражения, первая медицинская помощь пострадавшим, как правило, оказывается в порядке само- и взаимопомощи, силами объектовых аварийно-спасательных подразделений, спасателями МЧС, а также медицинским персоналом пострадавших объектов, санитарными дружинами (постами) работающей смены. Роль поликлиники (здравпункта, медсанчасти) аварийного объекта заключается в организации и руководстве оказания помощи поражённым, выделения бригад врачей и медсестер для работы в очаге поражения и организации пунктов сбора пораженных вне зоны заражения. Первую медицинскую помощь вначале оказывают пострадавшим, находящимся вне завалов и пожаров, затем пострадавшим по мере их розыска и извлечения. Оказание первой медицинской помощи пострадавшим возлагается на медицинских работников соответствующих объектов и спасателей МЧС, координирующих свои действия с администрацией, другими службами объектов и командирами формирований, а при их отсутствии на последних. В химическом очаге любого масштаба все пострадавшие дети должны переноситься на носилках, им оказывается помощь в первую очередь (особенно детям грудного возраста).
Заключение
Итак, в данной работе мы охарактеризовали АХОВ – аммиак. Также дали определение аммиака – бесцветный газ с чрезвычайно острым, характерным, вызывающим слезы запахом, состоящий из 1 объема азота и 3 объемов водорода, а потому отвечающий формуле NH3.
Далее прогнозировали масштаб заражения аммиака при химической аварии.
Выяснили, что продолжительность испарения АХОВ примерно составит
1 час 21 мин, зона заражения составляет 8,22 км2.
Также, указали, как защитить население от аварийно химически-опасного вещества – аммиака и порядок оказания медицинской помощи в очаге поражения аммиаком.
Список литературы
1.
2.
3.