Репликация ДНК
| Загрузить архив: | |
| Файл: ref-22925.zip (335kb [zip], Скачиваний: 82) скачать |
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
РЕПЛИКАЦИЯ ДНК.
Реферат
студента 3 курса 6 группы
Ковальчука К.В.
Минск 2003г.
ОГЛАВЛЕНИЕ
Введение……………………………………………………………………………….3
Общий механизм репликации …………………………………………………………4
Основные ферменты репликации ……………………………………………………..5
Репликация у прокариот ……………………………………………………………….7
Репликация у эукариот …………………………………………………………………9
Заключение …………………………………………………………………………….. 11
Литература ………………………………………………………………………………11
|
|
Введение.
Вся информация о строении и функционировании любого организма содержится в закодированном виде в его генетическом материале, основу которого у подавляющего числа организмов составляет ДНК.Роль ДНК заключается в хранении и передаче генетической (наследственной) информации в живых организмах. Чтобы эта информация могла передаваться от одного поколения клеток (и организмов) к другому, необходимо её точное копирование и последующее распределение её копий между потомками. Процесс, с помощью которого создаются копии молекулы ДНК, называется репликацией. Перед тем как разделится, клетки с помощью репликации создают копию своего генома, и в результате клеточного деленияв каждую дочернюю клетку переходит одна копия. Благодаря этому, генетическая информация, содержащаяся в родительской клетке, не исчезает, а сохраняется и передаётся потомкам. В случае многоклеточных организмов передача этой информации осуществляется с помощью половых клеток, образующихся в результате мейотического деления и также несущих копию генома (гаплоидного). Их слияние приводит к объединению двух родительских геномов в одной клетке (зиготе). Из неё развивается организм, клетки которого несут генетическую информацию обоих родительских организмов. Таким образом, основное значение репликации заключается в снабжении потомства генетической информацией. Для обеспечения стабильности организма и вида ДНК должна реплицироваться полностью и с очень высокой точностью, что обеспечивается функционированием определённого набора белков. Замечательной особенностью ДНК является то, что она несёт гены кодирующие эти белки, и, таким образом, информация о механизме её собственного удвоения закодирована в ней самой.
Общий механизм репликации.
Точное самовоспроизведение ДНАвозможно благодаря её особой структуре. Модель структуры ДНК была обнародована Ф.Криком и Д.Уотсоном в 1953 году. Согласно ейДНК представляет собой длинную двухцепочечную полимерную молекулу. Мономерамиявляются нуклеотиды, соединённые в каждой цепи фосфодиэфирными связями. Сахарофосфатный остов молекулы, который состоит из фосфатных групп и дезоксирибозных остатков соединённых 5'-3'-фосфодиэфирными связями , образует как бы боковины винтовой лестницы, а пары оснований -её ступеньки.Две полинуклеотидные цепи навиты одна на одну, образуя двойную спираль. Вместе они удерживаются водородными связями , образующимися между комплиментарными основаниями противоположных цепей (между А и Т; G и C). Цепи молекул ДНК антипараллельны: одна из них имеет направление 5¢®3¢, другая 3¢®5¢. Последовательность мономерных единиц (дезоксирибонуклеотидов) в одной её цепи соответствует (комплиментарна) последовательности дезоксирибонуклеотидов в другой. Уотсон и Крик предположили, что для удвоения ДНК должны произойти разрыв водородных связей и расхождение цепей(рис.1) и что удвоение ДНК происходит путём последовательного соединения нуклеотидов на матрице материнской цепи в соответствии с правилом комплиментарности. В дальнейшем эта матричная природа механизма репликации была подтверждена многочисленными опытами. Подтверждение также получил предложенный полуконсервативный способ репликации двухцепочечной ДНК {Мезельсон, Сталь, 1958 (объект-E.coli); Тэйлор,1958( объект-Viciafaba)}.Согласно ему, в результате дупликации образуются две пары цепей, в каждой из которых только одна является родительской (консервативной), а вторая- заново синтезированной.Другие механизмы (консервативный, дисперсный) не подтвердились.
|
рис.1. Рис.1Модель репликации, предложенная Уотсоном и Криком. Комплиментарные цепи показаны разными цветами. |
 зоны, где происходила репликация. Эта зона двигалась вдоль родительской
двойной спирали. Из-за Y-образной
структуры её назвали репликативной вилкой. Именно в ней и происходят основные
процессы, обеспечивающие синтез ДНК. Вилки образуются в структуре, называемой
репликативный пузырёк. Это области хромосомы, где две нити родительской спирали
ДНК разъединяются и служат как матрицы для синтеза ДНК. Это место, где
происходит инициация репликации, называется точкой начала репликации (точкой ori). Образование
репликативных вилок происходит в двух направлениях (двунаправленная репликация)
и их они затем движутся до встречи с другой вилкой или с концом матрицы. В
некоторых случаях наблюдается движение только одной вилки, тогда как вторая
является стационарной (однонаправленная репликация). У прокариот на нуклеоиде
находится обычно только одна точка ori, тогда как у эукариот их много (например, у дрожжей порядка
500), расположенных на хромосоме на расстоянии 20-35 т.п.н. Участок между
двумя точками ori
получил название репликон. Скорость репликации у прокариот составляет порядка
1000-2000 нуклеотидов в секунду, у эукариот ниже из-за нуклеосомной организации
хроматина (10-200 нуклеотидов в секунду). Скорость репликации всей молекулы
ДНК (или хромосомы) зависит от числа и расположения точек ori.
зоны, где происходила репликация. Эта зона двигалась вдоль родительской
двойной спирали. Из-за Y-образной
структуры её назвали репликативной вилкой. Именно в ней и происходят основные
процессы, обеспечивающие синтез ДНК. Вилки образуются в структуре, называемой
репликативный пузырёк. Это области хромосомы, где две нити родительской спирали
ДНК разъединяются и служат как матрицы для синтеза ДНК. Это место, где
происходит инициация репликации, называется точкой начала репликации (точкой ori). Образование
репликативных вилок происходит в двух направлениях (двунаправленная репликация)
и их они затем движутся до встречи с другой вилкой или с концом матрицы. В
некоторых случаях наблюдается движение только одной вилки, тогда как вторая
является стационарной (однонаправленная репликация). У прокариот на нуклеоиде
находится обычно только одна точка ori, тогда как у эукариот их много (например, у дрожжей порядка
500), расположенных на хромосоме на расстоянии 20-35 т.п.н. Участок между
двумя точками ori
получил название репликон. Скорость репликации у прокариот составляет порядка
1000-2000 нуклеотидов в секунду, у эукариот ниже из-за нуклеосомной организации
хроматина (10-200 нуклеотидов в секунду). Скорость репликации всей молекулы
ДНК (или хромосомы) зависит от числа и расположения точек ori.
Синтез ДНК в репликативной вилке проходит следующим образом. Цепи синтезируются в результате присоединения 5¢-дезоксинуклеотидильных единиц дезоксирибонуклеотидтрифосфатов к 3¢-гидроксильному концу уже имеющейся цепи (праймер, затравка). За один акт репликации праймерная цепь удлиняется на один нуклеотид, при этом одновременно удаляется один остаток пирофосфата. Цепи синтезируются в направлении 5¢®3¢ вдоль матричной цепи, ориентированной в противоположном, 3¢®5¢, направлении. Синтез Цепей в обратном направлении не происходит никогда, поэтому синтезируемые цепи в каждой репликативной вилке должны расти в противоположных направлениях. Синтез одной цепи(ведущей, лидирующей) происходит непрерывно, а другой (отстающей) импульсами. Такой механизм репликации называется полунепрерывным. Ведущая цепь растёт от 5¢- к 3¢-концу в направлении движения репликативной вилки и нуждается только в одном акте инициации. Рост отстающей цепи также идёт от 5¢- к 3¢-концу, но в направлении противоположном движению репликативной вилки. Для синтеза отстающей цепи должно произойти несколько актов инициации, в результате чего образуется множество коротких цепей, называемых фрагменты Оказаки в честь открывшего их учёного - Р.Оказаки. Размеры их: 1000-2000 нуклеотидов у прокариот, 100-200 нуклеотидов у эукариот. По мере движения репликативной вилки концы соседних фрагментов Оказаки соединяются с образованием непрерывной отстающей цепи. Механизмы инициации репликации в точке ori и при образовании фрагментов Оказаки в принципе аналогичны. В обоих случаях происходит образование РНК- затравок (длиной 10-12 нуклеотидов), комплиментарных матричной ДНК, в виде продолжения которых синтезируется новая цепь ДНК. В дальнейшем короткие вставки РНК замещаются сегментами ДНК, которые затем объединяются с образованием непрерывных цепей.
Основные ферменты репликации.
Репликация является ферментативным процессом, а не спонтанным как сначала предполагали Уотсон и Крик. В репликации участвуют следующие основные группы ферментов.
ДНК-полимеразы. Ферменты, которые узнают нуклеотид материнской цепи, связывают комплиментарный нуклеозидтрифосфат и присоединяют его к 3¢-концу растущей цепи 5¢-концом. В результате образуется 5¢-3¢-диэфирная связь, высвобождается пирофосфат и растущая цепь удлиняется на один нуклеотид. Таким образом, ДНК-полимераза движется от 3¢- к 5¢-концу молекулы материнской ДНК, синтезируя новую цепь. ДНК-полимеразе для работы нужен праймер (т.е. 3¢-ОН группа для присоединения нового нуклеотида) и матрица, детерминирующая присоединение нужного нуклеотида. ДНК-полимеразы помимо полимеразной активности, имеют экзонуклеазную активность, они способны к гидролизу фосфодиэфирных связей в одной цепи ДНК или на не спаренном конце дуплексной ДНК. Заодин акт удаляется один нуклеотид, начиная с 3¢-конца цепи (3¢-5¢-экзонуклеаза) или с 5¢-конца цепи дуплексной ДНК (5¢-3¢-экзонуклеаза). Эти различные активности присущи разным сайтам полипептидной цепи ДНК-полимераз. 3¢-5¢-экзонуклеазная активность обеспечивает контроль за присоединением каждого нуклеотида и удаление ошибочных нуклеотидов с растущего конца цепи. Все ДНК-полимеразы способы осуществлять данный тип реакции. Многие(но не все) ДНК-полимеразы обладают также 5¢-3¢-экзонуклеазной активностью. При сочетании 5¢-3¢-экзонуклеазной и полимеразной активностей происходит последовательное отщепление нуклеотидов с 5¢-конца одноцепочечного разрыва в дуплексе и удлинение цепи с 3¢-конца. В результате место разрыва перемещается по цепи в направлении от 5¢- к 3¢- концу(так называемая ник-трансляция).
ДНК-лигазы --ферменты, осуществляющие соединение цепей ДНК, т.е. катализирующие образование фосфодиэфирных связей между 5¢-фосфорильной и 3¢-гидроксильной группами соседних нуклеотидов в местах разрывов ДНК.Для образования новых фосфодиэфирных связей требуется энергия в форме АТФ либо НАД.
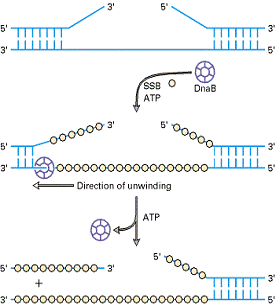 ДНК-геликазы
(ДНК-хеликазы)—ферменты, осуществляющие расплетание двойной спирали ДНК.
Для разделения цепей используется энергия АТФ. Геликазы часто функционируют в
составе комплекса, осуществляющего перемещение репликативной вилки и
репликацию расплетённых цепей. Для расплетания достаточно одного геликазного
белка, но длятого. Чтобы максимизировать
скорость раскручивания. Несколько геликаз могут действовать совместно.
ДНК-геликазы
(ДНК-хеликазы)—ферменты, осуществляющие расплетание двойной спирали ДНК.
Для разделения цепей используется энергия АТФ. Геликазы часто функционируют в
составе комплекса, осуществляющего перемещение репликативной вилки и
репликацию расплетённых цепей. Для расплетания достаточно одного геликазного
белка, но длятого. Чтобы максимизировать
скорость раскручивания. Несколько геликаз могут действовать совместно.
|
Рис.2Геликазная активность белка DnaBE.coli[3]. |
 ДНК-топоизомеразы—ферменты,
изменяющие степень сверхспиральности и тип сверхспирали. Путём одноцепочечного
разрыва они создают шарнир, вокруг которого нереплецированный дуплекс ДНК,
находящейся перед вилкой, может свободно вращаться. Это снимает механическое
напряжение, возникающее при раскручивании двух цепей в репликативной вилке, что
является необходимым условием для её непрерывного движения. Кроме того,
топоизомеразы (типа II)
обеспечивают разделение или образование катенанов - сцепленных кольцевых ДНК
(образуются в результате репликации кольцевой ДНК), а также устранение узлов
и спутанных клубков из длинной линейной ДНК. Существует два типа топоизомераз.
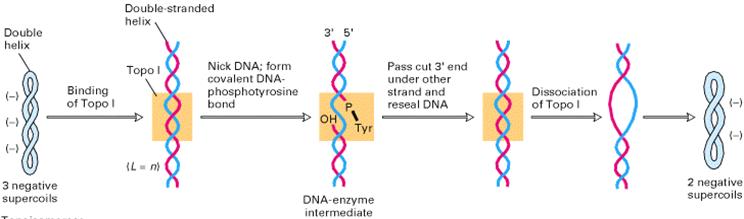
Топоизомеразы типа I
уменьшают число сверхвитков в ДНК на единицу за один акт. Эти топоизомеразы
надрезают одну из двух цепей, в результате чего фланкирующие дуплексные области
могут повернутся вокруг интактной цепи, и затем воссоединяют концы разрезанной
цепи. Эта реакция не требует энергии
АТФ, т.к. энергия фосфодиэфирной связи сохраняется благодаря тому, что
тирозиновый остаток в молекуле фермента выступает то в роли акцептора, то в
роли донора фосфорильного конца разрезанной цепи.
ДНК-топоизомеразы—ферменты,
изменяющие степень сверхспиральности и тип сверхспирали. Путём одноцепочечного
разрыва они создают шарнир, вокруг которого нереплецированный дуплекс ДНК,
находящейся перед вилкой, может свободно вращаться. Это снимает механическое
напряжение, возникающее при раскручивании двух цепей в репликативной вилке, что
является необходимым условием для её непрерывного движения. Кроме того,
топоизомеразы (типа II)
обеспечивают разделение или образование катенанов - сцепленных кольцевых ДНК
(образуются в результате репликации кольцевой ДНК), а также устранение узлов
и спутанных клубков из длинной линейной ДНК. Существует два типа топоизомераз.
Топоизомеразы типа I
уменьшают число сверхвитков в ДНК на единицу за один акт. Эти топоизомеразы
надрезают одну из двух цепей, в результате чего фланкирующие дуплексные области
могут повернутся вокруг интактной цепи, и затем воссоединяют концы разрезанной
цепи. Эта реакция не требует энергии
АТФ, т.к. энергия фосфодиэфирной связи сохраняется благодаря тому, что
тирозиновый остаток в молекуле фермента выступает то в роли акцептора, то в
роли донора фосфорильного конца разрезанной цепи.
|
Рис.3 Действие топоизомеразы I (TopoI). [3.] |

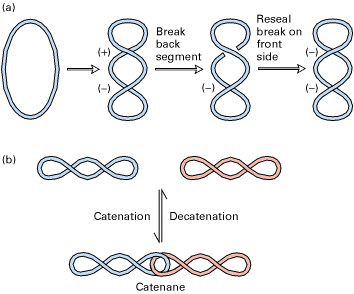
 Топоизомеразы типа II вносят временные разрывы в обе
комплиментарные цепи, пропускают двухцепочечный сегмент той же самой или
другой молекулы ДНК через разрыв, а затем соединяют разорванные концы. В результате
за один акт снимаются два положительных или отрицательных сверхвитка. Топоизомеразы
типа II тоже используют
тирозиновые остатки для связывания 5¢-конца каждой
разорванной цепи в то время . когда другой дуплекс проходит через место
разрыва.
Топоизомеразы типа II вносят временные разрывы в обе
комплиментарные цепи, пропускают двухцепочечный сегмент той же самой или
другой молекулы ДНК через разрыв, а затем соединяют разорванные концы. В результате
за один акт снимаются два положительных или отрицательных сверхвитка. Топоизомеразы
типа II тоже используют
тирозиновые остатки для связывания 5¢-конца каждой
разорванной цепи в то время . когда другой дуплекс проходит через место
разрыва.
Праймаза—фермент, обладающий РНК-полимеразной активностью; служит для образования РНК-праймеров, необходимых для инициации синтеза ДНК в точке ori и дальнейшем для синтеза отстающей цепи.
|
Рис.4 Действие топоизомеразы II: (a) образование отрицательных сверхвитков, (b) разделение и образование катенанов[3]. |
Репликация у прокариот.
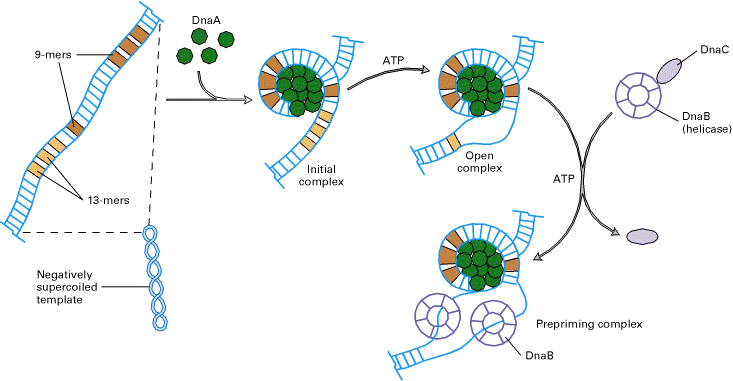 Escherichiacoli.
У этой бактерии (как и ещё некоторых исследованных видов) в области точки инициации
репликации (oriC,
длиной примерно 245 п.н.) находятся повторы размером в 13 и 9 пар оснований
(Рис.5). При инициации 10-20 молекул белка инициации репликации DnaA связывается с четырьмя
девятимернымиповторами (9-mers) и расплетает ДНК в
районе тандемного набора тринадцатимеров, богатых АТ парами (что облегчает их
расплетание, т.к. между А и Т только две водородные связи). Белок DnaC доставляет
шестисубъединичный белок DnaB
(геликаза) к матрице. На каждую из одиночных цепей садится по одному DnaBи они затем двигаются в разных направлениях
расплетая ДНК.
Escherichiacoli.
У этой бактерии (как и ещё некоторых исследованных видов) в области точки инициации
репликации (oriC,
длиной примерно 245 п.н.) находятся повторы размером в 13 и 9 пар оснований
(Рис.5). При инициации 10-20 молекул белка инициации репликации DnaA связывается с четырьмя
девятимернымиповторами (9-mers) и расплетает ДНК в
районе тандемного набора тринадцатимеров, богатых АТ парами (что облегчает их
расплетание, т.к. между А и Т только две водородные связи). Белок DnaC доставляет
шестисубъединичный белок DnaB
(геликаза) к матрице. На каждую из одиночных цепей садится по одному DnaBи они затем двигаются в разных направлениях
расплетая ДНК.
|
У прокариот обнаружено три типа ДНК-полимераз. Их свойства приведены ниже.
|
Свойство / тип полимеразы |
I |
II |
III |
||
|
полимеризация: 5¢-3¢ |
+ |
+ |
+ |
||
|
экзонуклеазная активность: |
|||||
|
5¢--3¢ |
+ |
+ |
+ |
||
|
3¢--5¢ |
+ |
-- |
-- |
||
|
синтез на: |
|||||
|
ДНК без праймера |
-- |
-- |
-- |
||
|
одноцепочечная ДНК с праймером |
+ |
-- |
-- |
||
|
одноцепочечная ДНК с праймером и SSB-белками |
+ |
-- |
+ |
||
|
скорость синтеза (нуклеотиды в минуту) |
600 |
? |
30000 |
||
|
|
400 |
? |
10--20 |
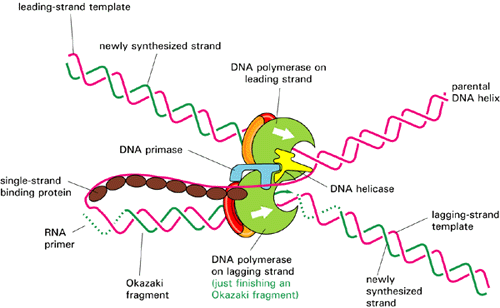 IIIосуществляет удлинение лидирующей цепи, а
также удлинение РНК-праймеров с образованием фрагментов Оказаки длиной от
1000 до 2000 нуклеотидов. Две ДНК-полимеразы связаны между собой t-субъединицей. Удаление сегментов РНК с 5¢-конца
каждого фрагмента Оказаки и заполнение пробелов между ними катализируетcя ДНК-полимеразой I ,способной удлинять цепь и
осуществлять ник-трансляцию. Когда растущий 3¢-гидроксильный конец
каждого фрагмента Оказаки доходит до 5¢ –дезоксинуклеотидного
конца соседнего фрагмента, вступает в действие ДНК- лигаза и образуется непрерывная
отстающая цепь. Роль ДНК-полимеразы II в репликации не выяснена.
IIIосуществляет удлинение лидирующей цепи, а
также удлинение РНК-праймеров с образованием фрагментов Оказаки длиной от
1000 до 2000 нуклеотидов. Две ДНК-полимеразы связаны между собой t-субъединицей. Удаление сегментов РНК с 5¢-конца
каждого фрагмента Оказаки и заполнение пробелов между ними катализируетcя ДНК-полимеразой I ,способной удлинять цепь и
осуществлять ник-трансляцию. Когда растущий 3¢-гидроксильный конец
каждого фрагмента Оказаки доходит до 5¢ –дезоксинуклеотидного
конца соседнего фрагмента, вступает в действие ДНК- лигаза и образуется непрерывная
отстающая цепь. Роль ДНК-полимеразы II в репликации не выяснена.
Обнаружен специальный белок терминации – Tus-белок. Он задерживает геликазу, в результатечего прекращается расплетение нити и происходит терминация репликации.
|
Репликация у эукариот.
Как и в случае с E.coli исследованиярепликации в эукариотических клетках сначала были сосредоточены на характеристике различных ДНК-полимераз (см. табл.2).
|
свойство / тип полимеразы |
a |
b† |
d |
g |
e |
|
полимеризация: 5¢-3¢ |
+ |
+ |
+ |
+ |
+ |
|
экзонуклеазная активность: ‡3¢-5¢ |
-- |
-- |
+ |
+ |
+ |
|
синтез от: |
|||||
|
ДНК-праймера |
+ |
+ |
+ |
+ |
+ |
|
РНК-праймера |
+ |
-- |
-- |
+ |
? |
|
связь с ДНК-праймазой |
+ |
-- |
-- |
-- |
-- |
|
расположение в клетке: |
|||||
|
ядро |
+ |
+ |
-- |
+ |
+ |
|
митохондрии |
-- |
-- |
+ |
-- |
-- |
Табл.2 Свойства ДНК-полимераз клеток млекопитающих *.
*ДНК-полимеразы дрожжей аналогичны полимеразам a, b ,g соответственно
† ДНК-полимераза наиболее активна на молекулах ДНК с брешами около 20 нуклеотидов ипредположительноучаствует в репарации ДНК
‡ FEN1- эукариотическая 5¢-3¢ экзонуклеаза, удаляющая РНК-праймеры; по своей
структуре и функциям она схожа с доменом ДНК-полимеразы IE.coli имеющего 5¢-3¢ экзонуклеазную активность.[3].

Следующим этапом стало создание систем для репликации хромосом вирусов животных invitro. В результате в настоящее время хромосома вируса SV40 может быть реплицирована invitro с использованием всего лишь восьми компонентов клеток млекопитающих. По своим свойствам эти белки напоминают белки необходимые для репликации в E.coli. Репликация ДНК эукариот также идёт в двух направлениях; для синтеза ДНК нужны праймеры синтезируемые праймазой; синтез лидирующей цепи непрерывен, а отстающей прерывистый. Как показано на рис.7, инициация репликации ДНК вируса SV40 происходит в уникальном сайте, точке начала репликации, путём связывания кодируемого вирусом белка, называемого Tantigen, или Tag.
Этот полифункциональный белок расплетает дуплекс ДНК благодаря своей геликазной активности. Расплетание дуплекса требует также наличия АТФ и белка репликации A (RPA), кодируемого клеткой-хозяином и обладающего способностью связываться с однонитчатой ДНК (как SSB-белки в E.coli). Одна молекула ДНК-полимеразы α (Pol α) прочно связывается с праймазой и затем связывается с образовавшейся однонитчатой ДНК. Праймаза образует РНК-праймеры, которые затем удлиняются на небольшую длину Pol α , образуя первую часть ведущих цепей, которые растут от точки ori в противоположных направлениях. Активность Pol α стимулируется фактором репликации C (RFC).
Затемc 3-концамb удлинённых Pol α РНК-праймеров связывается PCNA (proliferating cell nuclear antigen) и замещает Pol α на обоих растущих ведущих цепях, прерывая их синтез. На следующем этапе Pol δ связывается с PCNA на 3¢-концах растущих цепей. PCNA повышает процессивность Pol δ так, что полимераза может непрерывно продолжать синтез ведущих цепей. Таким образом, функция PCNA аналогична функции β-субъединицы полимеразы IIIE.coli, т.к. оба белка образуют сходные структуры (“кольца”), охватывающие ДНК и способствующие удержанию полимераз на цепи ДНК. Они, однако, имеют различные первичные структуры; кроме того PCNA-тример, а не димер как β-субъединица полимеразы IIIE.coli.
Комплекс праймаза- Pol α. садится на цепь, являющуюся матрицей для отстающей цепи и вместе с RFC осуществляют синтез запаздывающей цепи.
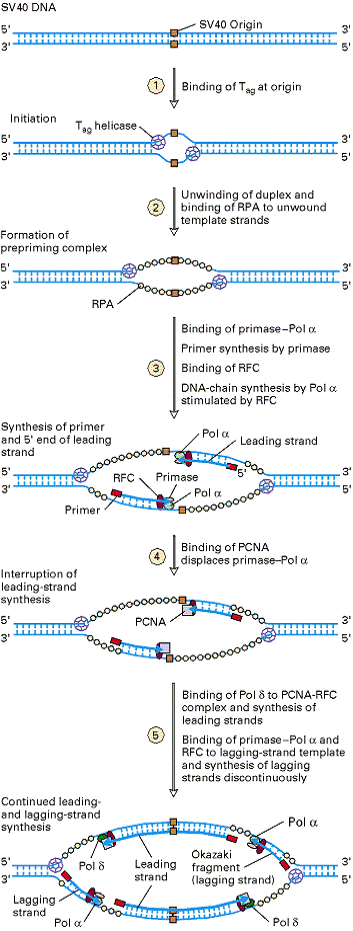 Наконец, как и в E.coli
топоизомеразы снимают механическое напряжение, возникающее при расплетании
ДНК в репликативной вилке, и участвуют в разделении двух дочерних хромосом.
Однако топоизомеразы эукариот имеют некоторые отличия от прокариотических: 1.топоизомеразы
I эукариот взаимодействуют с 3¢-фосфорильным концом
разорванной цепи (прокариотические --с 5¢-фосфорильным концом) 2.
топоизомеразы I эукариот устраняют как отрицательные, так и положительные
сверх витки (прокариотические—только отрицательные) 3.топоизомеразы II эукариот
не способны индуцировать образование отрицательных сверхвитков (как это
делает в релаксированных кольцевых ДНК гираза бактерий).
Наконец, как и в E.coli
топоизомеразы снимают механическое напряжение, возникающее при расплетании
ДНК в репликативной вилке, и участвуют в разделении двух дочерних хромосом.
Однако топоизомеразы эукариот имеют некоторые отличия от прокариотических: 1.топоизомеразы
I эукариот взаимодействуют с 3¢-фосфорильным концом
разорванной цепи (прокариотические --с 5¢-фосфорильным концом) 2.
топоизомеразы I эукариот устраняют как отрицательные, так и положительные
сверх витки (прокариотические—только отрицательные) 3.топоизомеразы II эукариот
не способны индуцировать образование отрицательных сверхвитков (как это
делает в релаксированных кольцевых ДНК гираза бактерий).
Итак, получено много данных об эукариотических белках, осуществляющих репликацию ДНКвируса SV40 in vitro. Как упоминалось ранее, инициация репликации ДНК SV40 invitro требует наличие вирусного белка - T антигена. Для инициации же репликации у эукариот хромосомной ДНКнеобходим целый комплекс белков. Так, у дрожжей с сайтом ori в течение всего жизненного цикла связан комплекс из 6 разных белков (ORC), к которому в интерфазе присоединяется ещё целый ряд белков и образованный комплекс инициирует процесс репликации. Такие же белки синтезируются всеми эукариотическими клетками.
|
Рис.7 Модель репликации ДНК вируса SV40 invitro с помощью эукариотических ферментов.[3.] |
 Хромосомы эукариот линейны и их концы представлены теломерами, состоящими
из повторяющихся олигомерных последовательностей; у человека это 25-200 копий
последовательности TTAGGG. Наличие специальной области на концах
эукариотических хромосом абсолютно необходимо. Дело в том, что при удалении
последнего РНК-праймера отстающей цепи, на 5-конце этой цепи остаётся брешь,
которую не способна заполнить ни одна из ДНК-полимераз, т.к. всем им для работы
необходим праймер со свободным 3-ОН концом. Без существования какого-либо
специального механизма дочерняя нить ДНК, синтезируемая на отстающей цепи,
укорачивалась бы с каждым клеточным делением. Ферментом, предотвращающим
такое укорочение, является теломераза. Этот фермент имеет ассоциированную с ним
короткую нить РНК, комплиментарную шестичленной последовательности,
повторяющейся в теломере и служащую матрицей для синтеза ДНК теломеров. Благодаря
этому механизму эукариотические хромосомы могут реплицироваться полностью.
Репликация в большинство соматических клеток проходит без участия теломеразы,
поэтому с каждым делением длина хромосом клетки укорачивается и после
определённого числа делений хромосомы утрачивают теломеры и начинают терять
смысловые участки , что приводит к гибели клетки.Теломераза активна в половых, раковых клетках
и клетках одноклеточных эукариот.
Хромосомы эукариот линейны и их концы представлены теломерами, состоящими
из повторяющихся олигомерных последовательностей; у человека это 25-200 копий
последовательности TTAGGG. Наличие специальной области на концах
эукариотических хромосом абсолютно необходимо. Дело в том, что при удалении
последнего РНК-праймера отстающей цепи, на 5-конце этой цепи остаётся брешь,
которую не способна заполнить ни одна из ДНК-полимераз, т.к. всем им для работы
необходим праймер со свободным 3-ОН концом. Без существования какого-либо
специального механизма дочерняя нить ДНК, синтезируемая на отстающей цепи,
укорачивалась бы с каждым клеточным делением. Ферментом, предотвращающим
такое укорочение, является теломераза. Этот фермент имеет ассоциированную с ним
короткую нить РНК, комплиментарную шестичленной последовательности,
повторяющейся в теломере и служащую матрицей для синтеза ДНК теломеров. Благодаря
этому механизму эукариотические хромосомы могут реплицироваться полностью.
Репликация в большинство соматических клеток проходит без участия теломеразы,
поэтому с каждым делением длина хромосом клетки укорачивается и после
определённого числа делений хромосомы утрачивают теломеры и начинают терять
смысловые участки , что приводит к гибели клетки.Теломераза активна в половых, раковых клетках
и клетках одноклеточных эукариот.
Заключение.
Нужно отметить, что существует ряд объектов, репликация которых проходит по несколько иному механизму, чем было описано выше. Так, например, кольцевая ДНК митохондрий и хлоропластов реплицируется с образованием D-петель (сначала начинает реплицироваться одна цепь, в результате чего образуется структура в форме D, а после репликации более половины первой нити, начинает синтезироваться вторая); ряд плазмид и ДНК некоторых вирусов реплицируется по типу катящегося кольца и т.п. Однако принципиальная схема репликации для всех биологических объектов остаётся одной и той же.
Литература.
1. Гены и геномы. М.Сингер, П.Берг. – М.: Мир, 1998. –376 с.
2.
Molecular Biology of the Cell. 3rd ed.
Alberts, Bruce; Bray, Dennis; Lewis, Julian; Raff, Martin; Roberts,
Keith; Watson, James D.
New York and London: Garland Publishing; c1994
3.
Molecular Cell Biology. 4th ed.
Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul;
Baltimore, David; Darnell, James E.
New York: W H Freeman & Co; c2000.