Ломоносов и его жизнедеятельность
| Загрузить архив: | |
| Файл: ref-22965.zip (535kb [zip], Скачиваний: 129) скачать |
План
1. Химия как наука.
2. Главная работа Ломоносова, как химика.
3. Металлы и кислые спирты.
4. Соль и новые открытия.
5. Корпускулярная теория.
6. Химическая лаборатория и её возможности.
7. Смальты.
8. Физическая химия.
9. Гениальный человек.
М. В. Ломоносов считал химию одной из главных областей своего научного творчества. Не зря в течение двух веков химию называли спагирической наукой отгреческого спао -– отделять и агейро -– соединять. Он начал заниматься химическими исследованиями уже в ранний период своей деятельности, будучи студентом Марбургского университета. Первый научный труд Ломоносова ««»»»»»О превращении твердого тела в жидкое, в зависимости от движения предсуществующей жидкости»» написан в 1738 г. Вторая работа ««»»»«О различии смешанных тел, состоящем в сцеплении корпускул»» была завершена год спустя. Эти работы будущего ученого явились началом изучения мельчайших частичек материи, из которых состоит вся природа. Через два десятилетия они оформились в стройную атомно-молекулярную концепцию, обессмертившую имя ее автора.
Вернувшись в 1741 г. на родину Ломоносов приступил к экспериментальным исследованиям в области химии. К сожалению, сохранилось очень мало материалов, характеризующих научную деятельность молодого ученого в 40-х годах. Нет, например, сведений об опытах по получению и исследованию «горючего пара», о которых впоследствии Ломоносов упоминал в диссертации ««О металлическом блеске»». Но ещё в 1751 году М.В. Ломоносов выступил с речью, названной им«Слово о пользе химии». В общих чертах там говорилось о единстве принципов теории и практики, науки и производства. В одной из своих ранних работ, «Элементы математической химии», Ломоносов предложил краткое определение химии.
Химия - –наука обизменениях, происходящих в смешанном теле………. Таким образом, в этой формулировке предмета химии Ломоносов впервые представляет её в виде науки, а не искусства.
Отметим, что Ломоносов, считал, что чистых веществ в природе почти не существует, что все тела являются смешанными. «Элементы математической химии»» представляли собой как бы программу будущих физико-химических исследований, многие темы которой им были впоследствии осуществлены. Ломоносов считал, что истинный химик должен быть одновременно и практиком, и теоретиком, т. е. практиком, способным «положить в основание химии начала механики». Он полагал, что «глубже проникнуть в таинства природы» можно лишь на основе применения к химическим процессам разработанной им корпускулярной философии. Он разделяет корпускулы на однородные и разнородные, первые из которых состоят из «одинакового числа элементов одних и тех же, соединенных между собой одинаковым образом». Ко вторым он относит те корпускулы, у которых «элементы их различны и соединены различным образом или в различном числе. От этого зависит бесконечное разнообразие тел».
На этой основе Ломоносов разделяет химические вещества на «начала», «смешанные» и «составные».
Весной 1743 г. Ломоносов написал первый вариант своей известной работы ««О действии химических растворителей вообще»». Кончался период ее чисто экспериментального развития, когда химики производили с химическими веществами различные операции в большинстве случаев вслепую или на основе туманных представлений, которые оставила в наследство алхимия.
1744 г., получив необходимые химические препараты, Ломоносов осуществил большую серию экспериментов по растворению металлов в кислотах и солей в воде. Эти опыты подробно изложены в окончательном варианте работы, представленном в Академию наук 7 декабря 1744 г. и прочитанном в Академическом собрании в марте следующего года.
Ломоносов разделил все процессы растворения на две группы. К одной он отнёс растворение металлов в кислотах, когда в процессе растворения выделяется тепло, а к другой – растворение солей в воде с поглощением тепла. Сначала Ломоносов растворял тонкую железную проволоку в азотной кислоте разной концентрации, наблюдая через микроскоп ход растворения металла. Ломоносов заметил огромную массу отбрасываемых частиц с бесчисленными пузырьками, непрерывно следовавшими друг за другом. Ломоносовобратил внимание, что при растворении металлов в кислотах наблюдается разогревание, а при растворении солей – охлаждение. Затем он определял количество выделенного при этом газа и его состав. Далее ученый исследовал растворимость гидрата окиси железа и уксуснокислой меди (медной зелени) в азотной кислоте, крепкой и разбавленной. При этом Ломоносов наблюдал и описал явление, известное в наше время как пассивация металла, при котором на его поверхности образуется тонкая защитная пленка, резко замедляющая процесс коррозии. Продолжая свои исследования растворимости металлов в кислотах, Ломоносов осуществил эксперименты растворения меди в условиях вакуума, изучал специфику растворения в азотной кислоте различных металлов: железа, меди, цинка, серебра, свинца и даже ртути. Полученные результаты он сопоставлял с удельным весом металлов. Выделение тепла в реакциях Ломоносов объяснял следующим образом:» « Частицы металла разносятся по растворителю, воздействуют трением на частицы последнего и приводят их во вращение и так каквращательное движение есть причина теплоты».
Процессы растворения металлов и солей Ломоносов объяснял с механических позиций, характерных для его эпохи. Подобно Р. Бойлю, он был уверен в пористой структуре как металлов и солей, так и жидких растворителей. В процессе растворения, по мнению Ломоносова, воздух, содержащийся в порах кислоты, внедряется в поры металла и, соединяясь там со «сгущенным» воздухом металла, приобретает «огромную упругость», ломая металл на мельчайшие частицы, наблюдавшиеся в микроскоп. Избытки «воздуха», образующегося при химическом взаимодействия кислоты и металла, являются одним из продуктов реакции. Ломоносов не знал тогда, что это был водород, свойства которого были изучены А. Лавуазье через два десятилетия после смерти Ломоносова.
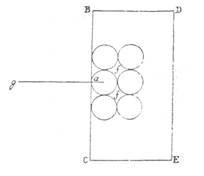
Итак, частицы металла отбрасываются силою растворителя в направлении, перпендикулярном к поверхности растворяемого тела. Примем, что частица аfотталкивается действием растворителя от поверхности ВС тела BCDEв направлении а а; необходимо, чтобы растворитель действовал на нее в том же направлении, т. е. толкал ее ота а к g; но толкать ота a к gон может не иначе, как ударяя в часть поверхности растворяемого тела ff, по другую сторону от ближайшей
поверхности растворения ВС; в нее растворитель не может ударить, если он предварительно не поместился между частицей afи остальными частями растворяемого тела в пространствах ff; т. е. кислотные спирты могут растворять металлы не иначе, как входя в их поры.
 Совсем
по-другому объяснял Ломоносов растворение солей в воде. «Когда твердые тела
делаются жидкими,— писал он,— то частицы их приходят в более быстрое
вращательное движение... Вследствие этого частицы соли отделяются от остальной
массы и, сцепляясь с водными частицами, вместе с ними начинают двигаться
поступательно и разносятся по растворителю». Таким образом, процессы
растворения Ломоносов объяснял движением частиц жидкости, приводящим в движение
частицы твердого тела. Это было то общее, что делало внешне сходными процессы
растворения металлов и солей. «Что вода движется внутренним движением,—
указывал он,— доказывает растворение солей. Положи только в воду кусок
какой-нибудь соли: он упадет на дно, и через час или два ты найдешь всю воду
воспринявшей эту соль». То же, по его словам, относится и к другим растворителям,
«силою которых растворяются и переходят в жидкое состояние металлы».
Совсем
по-другому объяснял Ломоносов растворение солей в воде. «Когда твердые тела
делаются жидкими,— писал он,— то частицы их приходят в более быстрое
вращательное движение... Вследствие этого частицы соли отделяются от остальной
массы и, сцепляясь с водными частицами, вместе с ними начинают двигаться
поступательно и разносятся по растворителю». Таким образом, процессы
растворения Ломоносов объяснял движением частиц жидкости, приводящим в движение
частицы твердого тела. Это было то общее, что делало внешне сходными процессы
растворения металлов и солей. «Что вода движется внутренним движением,—
указывал он,— доказывает растворение солей. Положи только в воду кусок
какой-нибудь соли: он упадет на дно, и через час или два ты найдешь всю воду
воспринявшей эту соль». То же, по его словам, относится и к другим растворителям,
«силою которых растворяются и переходят в жидкое состояние металлы».
Ломоносов правильно подметил тот случай, когда разбавленная водой кислота лучше растворяет металл, чем концентрированная. Известно, например, что многие металлы не растворяются в очень концентрированной серной кислоте, а в разбавленной водой интенсивнорастворяются с выделением водорода.
Переходя к процессурастворения солей вводе,Ломоносов, прежде всего, отметил, что «все соли содержат значительное количество воды», она входит в «поры солей», и поэтому воздух, рассеянный в воде, не входит в них и «не может ни расширяться в них от возродившейся упругости, ни действовать на частицы солей». В этом случае, полагает ученый, «частицы соли отделяются друг от друга действием частиц самой воды». Вступая во взаимодействие с находящимися на поверхности частицами соли, вращающиесячастицыводы «трутся о них иодновременнооб однородные себе частицы воды, входящие в состав соли, и ускоряют их вращательное движение. Вследствие этого частицы соли отделяются от основной массы и, сцепляясь с водными частицами, вместе с ними начинают двигаться поступательно и разносятся по растворителю». При этом, ускоряя вращательное движение частиц соли, частицы воды теряют часть своего вращательного движения, поэтому раствор соли в воде охлаждается.
Следует заметить, что Ломоносов основывал свои умозаключения на собственных опытах по растворению металлов и солей в различных условиях и наблюдал, как уже говорилось, процесс растворения в сильный микроскоп с 360- кратным увеличением. В результате ему удалось описать очень точные и тонкие частные наблюдения и высказать новые взгляды на процесс растворения, основывающиеся на его корпускулярной философии.
Ломоносов предвосхищает явление гидратации, заключающееся в том, что ионы, на которые распадается в растворе соль, окружаются плотно пристающимик ним молекулами воды.
В 1745 году Ломоносов пишет работу « О металлическом блеске»», чуть позже « О рождении и природе селитры». Впоследней, учёный высказал взгляды о приложении физических законов к химии.
Прошло время, прежде чем учёный получил в своё распоряжение прекрасную химическую лабораторию.
В лаборатория производилась экспертная оценка
различных красок отечественного производства, и эти краски сравнивались с ввозимыми
из-за рубежа. Создавались исобственные
краски. Известно, что
удалосьполучить краску
«наподобие берлинской лазури»; предполагают, что создавались и другие краски.
Судя по отчетам, такие же работы велись в лаборатории в течение ряда лет, и в
результате удалось найти хорошие красящие вещества не только для прозрачных,
но и для непрозрачных цветных стекол — смальт. Их Ломоносов стал изготовлять
для мозаик вначале в химической лаборатории. Поиск стойких, не разлагающихся
при варке стекла красителей был кропотливым и сложным делом. Набор известных
в то время красителей был невелик, многие рецепты содержались мастерами в
секрете, по этому Ломоносову пришлось произвести множество опытов, в
которых проверялись не только рецептура, но и весь технологический процесс
варки цветного стекла. Отыскивались необходимые материалы для тиглей и огнеупоров
стекловаренных печей, определялся оптимальный режим варки. Как выяснил один из
исследователей научного творчества Ломоносова Б. Н. Меншуткин, основным
способом получения красителей было осаждение, в результате которого ученый
получал окрашенные гидраты оксидов или основных солей тяжелых металлов.
Особенно сложным оказалось раскрытие тщательно охраняемого мастерами секрета
варки рубиновых стекол. В результате большой серии опытных варок Ломоносов
сумел найти нужную концентрацию золота и способы его введения во фритту
(полуготовую стекольную массу) и в 1751 г. сумел создать такое стекло. 
Довольно большой производительностью отличались печи для варки стекла, называвшиеся «финифтяными печами». Они применялись не только для экспериментальных целей, но и для приготовления значительного количества цветного стекла первых мозаичных картин Ломоносова. Эти же печи могли использоваться и для производства фарфоровых изделий. В первой русской Химической лаборатории находились также обжигательные печи и специальные вертикальные печи, в которых длительное время можно было поддерживать заданный температурный режим. Кроме различных печей, в лаборатории находилось много стеклянных и металлических сосудов для хранения реактивов и проведения экспериментов, а также большое число экспериментальных приборов и измерительных аппаратов. Многие из них были сконструированы самим Ломоносовым. Среди последних назовем изобретенный Ломоносовым специальный прибор для фильтрования под вакуумом, значительно ускоряющий этот процесс.
Курс физической химии Ломоносов начинает с определения новой науки: « «Физическая химия есть наука, объясняющая на основании положений и опытов физики то, что происходит в смешанных телах при химических операциях. Она может быть названа также химической философией, но в совершенно другом смысле, чем та мистическая философия, где не только скрыты объяснения, но и сами операции производятся тайным образом»». Для того чтобы выяснить, «что происходит в химических телах при химических операциях», необходимо, считал Ломоносов, прежде всего, выяснить химический состав тел, или, говоря его языком, определить те «начала», из которых данное вещество состоит. Ученый был убежден, что всякое смешанное тело, какого бы сложного состава оно ни было, может быть разделено на составляющие, «в которых нельзя отделить друг от друга никакими химическими операциями или различить рассуждением разнородные тела». Ломоносов полагал, что существует две группы частных качеств химических тел. В первую группу он выделял те, которые зависят отразличного сцепления частиц. Ко второй группе частных качеств Ломоносов относил цвет, прозрачность, вкус, запах. Учёный разработал свою теорию, согласнокоторой любой цвет (кроме чёрного) можно разложить на три простые составляющие-–красный, жёлтый и голубой. Из выдвинутого Ломоносовым положения логически вытекает его утверждение, «чтоизменение смешанного тела происходит от прибавления или потери одной из нескольких составляющих».
Говоря о применяемой химиками воде, Ломоносов обращает внимание на имеющиеся в ней примеси, способные исказить картину химических изменений, поэтому следует «для физического познания составных частей применять самую чистую воду». Далее он указывает на то, что вода входит в состав многих химических веществ, что доказывается изменением их вида при прокаливании. Следовательно, вода, применяемая в качестве средства, должна строго различаться от той, которая «существует в самом теле как составная часть».
Надо сказать, что большинство физико-химических исследований и сочинений Ломоносова остались незаконченными. Можно предположить, что основной причиной тому была незаурядная разносторонность ученого.
В заключение подведем некоторый итог сделанному Ломоносовым в химии и физической химии. За сравнительно короткое время в основанной им химической лаборатории были заложены научные основы русской промышленности по производству цветного стекла. Разработаны приемы и методы аналитических исследований руд и сырья из различных месторождений России. Работы Ломоносова в области физической химии заложили основы развития этой науки в нашей стране.
И, пожалуй, самое важное в его трудах — это пропаганда химических знаний. Непревзойденным образцом такого рода остается ««Слово о пользе химии»», прочитанное в Академическом собрании в 1751 г. До сих пор живут сказанные тогда слова:««Широко распростирает химия руки свои в дела человеческие... Куда ни посмотрим, куда ни оглянемся, везде обращаются пред очами нашими успехи ея прилежания».
Использованная литература
1.Э.П. Карпеев « Михаил Васильевич Ломоносов».
2.Г.Е.Павлов, А.С.Фёдоров«Михаил Васильевич Ломоносов»
3.Ю.И.Соловьёв «История химии».
4.Е.Лебедев «Ломоносов».
5.Г.А.Лихоткин «Ломоносов в Петербурге».
6.М.В.Ломоносов «Полное собрание сочинений» т.1