Культивирование бактерий
| Загрузить архив: | |
| Файл: ref-26797.zip (50kb [zip], Скачиваний: 182) скачать |
ГОУВПО “Марийский государственный университет”
Кафедра биохимии и молекулярной биологии
Культивирование бактерий.
курсовая работа
Выполнил:
студент III курса Марийского государственногоуниверситета
биолого-химического факультета, очного отделения «Биоэкология»
Гайдай Роман Андреевич.
Руководитель:
Гажеева Тамара Петровна.
Йошкар-Ола, 2018г.
Содержание.
1.Основы жизнедеятельности микробных клеток--------------- 3 стр.
1.1Внутриклеточный рН.--------------------------------------------- 3 стр.
1.2Диапазон рН.-------------------------------------------------------- 3 стр.
1.3Природные среды. ------------------------------------------------- 3 стр.
1.4Регуляция рН среды. ---------------------------------------------- 3 стр.
1.5Влияние рН на микробные клетки. ---------------------------- 4 стр.
2.Микробный рост. ---------------------------------------------------- 4 стр.
2.1.Температурный диапазон.------------------------------------- 4 стр.
2.2.Микробный рост существенно зависит
от присутствия кислорода и других газов------------------------ 5 стр.
2.3Растворимость газов.---------------------------------------------- 5 стр.
2.4.Аэрация. ------------------------------------------------------------ 5 стр.
2.5.Контроль за концентрацией О2 ------------------------------- 5 стр.
2.6.СО2.----------------------------------------------------------------- 6 стр.
2.7.Активность воды и осмотическое давление зависят от концентрации растворенных осмотически активных частиц.-- 7 стр.
2.8. Давление и удаление кислорода, влияние на бактериальную клетку.----------------------------------------------------------------------- 8 стр.
3.0.Свет может служить источником энергии
для микроорганизмов. -------------------------------------------------- 9 стр.
3.1.Среды для выращивания бактерий.------------------------------ 9 стр.
3.2.Источники энергии.------------------------------------------------- 10 стр.
3.3.Основными питательными элементами служат углерод, азот, сера и фосфор.------------------------------------------------------------------- 10 стр.
3.4.Для выращивания чистых культур микроорганизмов необходима стерилизация сред и инструментов. ---------------------------------- 14 стр.
3.5.Рост можно измерять различными методами.------------------ 16 стр.
3.6.Подсчет колоний. ---------------------------------------------------- 18 стр.
3.7.Метод определения наиболее вероятного числа бактерий.- 19 стр.
4.0. Методы хранения культур обеспечивают
длительное поддержание их жизнеспособности.-------------------20 стр.
4.1.Работа микробиологов основана на методах
элективного культивирования и получения чистых культур.----21стр.
4.2. Полунепрерывное культивирование.---------------------------- 23 стр.
4.3.Методы консервирования основаны на подавлении микробного роста.-------------------------------------------------------------------------- 24 стр.
1.Основы жизнедеятельности микробных клеток.
1.1Внутриклеточный рН.
Большинство видов бактерий, способно расти в широком диапазоне рН (~ 4 ед.), но их быстрый рост наблюдается в более узком диапазоне примерно 2 ед. рН. При этом значение рН поддерживается, на постоянном, оптимальном уровне, который часто сильно отличается от рН среды. Регуляция внутриклеточного рН опосредована неизвестной пока сенсорной системой, и протонодвижущей силой.
Если рН среды, более щелочной, чем рН цитоплазмы, клетки бактерий, должны поглощать Н+ с использованием энергии мембранного потенциала.
1.2Диапазон рН.
Бактерии, для которых оптимальны значения рН, близкие к 7,0, например Е. соli, составляют группу нейтрофилов. Экстремофильные виды, приспособленные к очень низким значениям рН, называют ацидофилами. К ним относится, например, бактерия Thiobacillus ferroxidons, растущая при рН 2,0-8,0. Виды - алкалифилы растут в щелочных средах; например, для Bacillus alcaliphilusоптимальное значение рН составляет примерно 10,5. Внутри-клеточный рН у этих трех приведенных в качестве примеров бактерий равен примерно 7,6; 6,5 и 9 соответственно. Некоторые бактерии, такие как Acetobacterи Lactobacillus, способны сохранять жизнеспособность при экстремальных значениях рН в течение определенного времени. Большинство грибов предпочитает слабокислую среду.
1.3Природные среды.
Спектр значений рН в природных местообитаниях представлен на рис. 6.2. Алкалифилы способны выживать при рН > 10, но рост их возможен, как правило, при рН < 10. Многие бактерии при росте потребляют и/или образуют кислоты либо основания. Например, при использовании NH4CL в качестве источника азота клетки ассимилируют NНз, выделяя в среду НСL.
1.4Регуляция рН среды.
Для контроля за изменением рН среды при росте бактерий (например, как диагностическим признаком) в состав многих питательных сред вводят индикаторы рН (слабые органические кислоты или основания, яркоокрашенные в зависимости от протонирования / депротонирования). В качестве таких индикаторов используют бромфеноловый синий (рКа 4,0), метиловый красный (рКа 5,2) и тимоловый синий (рКа 8,9), в кислой форме приобретающие желтую окраску. Поддерживать значение рН среды в узком диапазоне позволяют автоматические системы контроля рН, состоящие из рН-электрода, рН-метра, системы регуляции/установки допустимых пределов изменения рН и насоса для добавления кислоты или основания.
1.5Влияние рН на микробные клетки.
Неблагоприятная концентрация Н+ и ОН~ в среде влияет на различные структурные и биохимические параметры микробных клеток, Цитоплазма хорошо забуферена; при ее буферной емкости для изменения рН на 1 ед. необходимо > 0,1 моль кислоты или щелочи. Изменение рН среды, в первую очередь влияет на клеточные покровы; диссоциация/протонирование входящих в их состав макромолекул, таких как липополисахариды, белки поверхностного слоя и компоненты плазматической мембраны, приводят к изменениям в локальном распределении заряда, и вследствие этого к нарушениям в делении, морфологии, адгезии и флокуляции клеток или к разрушению плазматической мембраны. Кроме того, сдвиги рН среды влияют на метаболизм. В промышленных технологиях путем изменения рН срёды вызывают остановку роста культуры и выделение того или иного продукта (трофофаза —> идиофаза). Когда в результате брожёния рН снижается до определенного критического уровня, в качестве конечного продукта начинает образовываться спирт, а не кислота + Н^. От рН среды зависит токсичность многих соединений. Слабые кислоты, такие как уксусная, пропионовая, сорбиновая (для всех трех рКа = 4,7) и бензойная (рКа .=,3,7), способны проникать через мембрану в протонированной форме [АН] путем пассивной диффузии. В цитоплазме они диссоциируют с образованием аниона [А~], не способного проникать через мембрану, и Н+ («ионная ловушка»), что приводит к снижению внутриклеточного рН. Ингибирующее действие эти кислоты оказывают лишь в том случае, если значение рН среды достаточно низкое, т. е. сравнимо с величиной их рК. Поскольку эти кислоты не токсичны для человека, их широко используют как консерванты в производстве пищевых продуктов.
2.Микробный рост.
2.1.Температурный диапазон.
Микробный рост. возможен в широком диапазоне температуры с пределами ниже 0 и выше 100 °С.
Для большинства прокариот интервал температур, в котором возможен рост, составляет примерно 40 °С; с высокой скоростью рост происходит в более узком интервале — примерно 20 °С (рис. 6.3). Минимальная, максимальная и оптимальная температуры (основные температурные точки) значительно варьируют среди прокариот. По отношению к температуре их условно делят на группы: мезофилы, термофилы и психрофилы. У мезофилов, к которым относится большая часть бактерий, оптимальная для роста темпера тура лежит в интервале между 20 и 42 °С. Среди этих организмов имеются термотолерантные виды, способные выживать при температуре 50 *С. Большинство термофильных видов растет при температуре до 70 °С. Таких значений она достигает, например, в гниющем компосте и на гретом солнцем поверхностном слое почвы. У отдельных термофильных организмов, называемых экстремальнымитермофилами или гипертермофилами, температурный оптимум .превышает70 °С;например, Sulfolobusacidocaldarius растет при 80 °С,Purrodictumoccultum— при 105 °С. В природе такие значения температурь встречаются только в зонах вулканической активности. Оптимальная температура для роста психрофильных бактерий не превышает 20 °С. ое обитают в морской воде с температурой около 5 °С, и в полярных областях земного шара. Некоторые бактерии хорошо растут при температуре —10 °С, в микроскопических водных «карманах на границе раздела между льдом и морской водой в этих условиях рост, по-видимому, лимитирован недостатком жидкой воды. При кратковременном нагревании до комнатной температуры психрофильные организмы погибают. В противоположность этому большинство мезофилов характеризуется психротолерантностью.
Быстрое изменение температуры среды от нормальной до экстремальной, например резкое охлаждение до 4 °С или нагревание до 54 °С, может вызвать повреждение клеток. Чувствительность к нагреванию зависит от влажности среды, а также от физиологического состояния культуры (в стационарной фазе роста клетки менее чувствительны, чем в фазе активного роста). От физиологического состояния культуры зависит и реакция клеток на быстрое охлаждение.
2.2.Микробный рост существенно зависит
от присутствия кислорода и других газов
Облигатно аэробные бактерии нуждаются для роста в молекулярном кислороде; для факультативных анаэробов предпочтительны аэробные условия, но они способны расти и в отсутствие О2 - Многие бактерии относятся к микроаэрофилам, т. е. приспособлены к росту при очень низком содержании кислорода в среде (например, 0,1-0,5%), типичном для природных местообитаний. Такие бактерии часто не удается культивировать в обычных лабораторных условиях; иногда их рост можно получить в виде тонких бактериальных пленок на поверхности плавающих частиц, где они понижают концентрацию кислорода благодаря дыхательной активности.
2.3Растворимость газов.
Кислород служит конечным акцептором электронов (в случае аэробных бактерий). Другие газы могут использоваться иным образом, например Н^, СН^ и СО, как доноры электронов и/или источники углерода, N2 —как источник азота, Н^З — как восстановитель, удаляющий кислород из среды, донор электронов и источник серы, СО^ — как дополнительный или единственный источник углерода. Кислород, подобно другим газам, относительно слабо растворим в воде (см. разд. 30.1.3). Растворимость любого газа прямо пропорциональна его парциальному давлению и снижается с увеличением температуры и осмотического давления.
2.4.Аэрация.
При большой плотности клеток в культуре аэробным бактериям необходима усиленная аэрация. Достаточное снабжение клеток кислородом можно обеспечить различными способами, позволяющими повысить скорость его массопереноса и увеличить площадь поверхности раздела газ/жидкость. С целью обеспечения доступа кислорода сосуды для культивирования
бактерий
закрывают пробками из пористого материала, чаще всего ваты. Для культивирования
аэробных микроорганизмов имеются специальные плоскодонные колбы (Эрленмейера
или Фернбаха) и колбы с отбойниками, в которые среду наливают небольшим слоем;
для большей эффективности газообмена эти колбы помещают на качалку. При
выращивании культур в объеме среды более
2.5.Контроль за концентрацией О2.
Количество
растворенного кислорода в среде поддерживают на постоянном уровне, регулируя
скорость потока газа, процентное содержание кислорода в газовой смеси и
скорость перемешивания (концентрацию О^ определяют при помощи кислородного
электрода; см. рис. 11.1). Эффективность подачи О2 в ферментер рассчитывают как
скорость абсорбции кислорода, выражая ее в ммоль О2, поступающих в
2.6.СО2.
При культивировании автотрофных бактерий, для которых диоксид углерода служит единственным источником углерода, его во многих случаях вносит в среду в виде NaНСОз - Необходимо учитывать, что концентрации растворенных СО^ и НСО^" и, следовательно, распределение углекислоты между жидкой и газовой фазами зависит от рН среды (см. разд. 6.2.1). Диоксид углерода необходим также гетеротрофным бактериям, так как он участвует в биосинтетических реакциях карбоксилирования. Многие патогенные и
симбиотические бактерии адаптированы к высокому парциальному давлению СО2 в организме-хозяине и часто могут расти только при высокой концентрации (примерно 10%) СО2 в газовой фазе. Тщательное удаление СО2 из среды с помощью щелочной ловушки приводит к остановке роста большинства бактерий.
2.7.Активность воды и осмотическое давление зависят от концентрации растворенных осмотически активных частиц.
Вода в живых организмах не только выполняет роль растворителя, но также служит субстратом многих ферментативных реакций, влияет на кон-формацию макромолекул, принимающих благодаря гидратации необходимую структуру, и поддерживает клеточный тургор. Доступность воды зависит от ее содержания в среде обитания, т. е. от уровня влажности, например почвы или хлеба, либо, в водных средах, от концентрации растворенных веществ — ионы (Nа+, С1- и др.), сахара и другие соединения конкурируют за молекулы воды и «связывают» их, переводя в недоступную для Организма форму. В этом смысле условия высокого содержания в жидкой среде соли или сахара аналогичны условиям сухости, но в целом влияние тех и других условий, как и механизмы адаптации к ним, различны. Тем не менее при обоих типах «сухости» диффузия воды происходит из области ее высокой концентрации (влажная область или низкая концентрация растворенных веществ) в область низкой концентрации (сухая область или высокая концентрация растворенных веществ). Доступность влаги для микроорганизмов оценивают с помощью такого показателя, как активность воды (ав) в среде, представляющего собой отношение давления водяного пара в исследуемой системе (растворе или твердой среде) к давлению пара над чистой водой. В среде, содержащей растворенные вещества, осмотическое давление (Р) и ав связаны следующим соотношением:


P= 
где R — газовая постоянная, Т — абсолютная температура и УЕ — объем 1 моль воды. В идеальном случае осмотическое давление раствора, содержащего 1 моль осмотически активных частиц (например, ионов Nа+ или С1- либо молекул глюкозы), составляет 22 бар (2,2 МПа). Эта величина соответствует давлению газа при его концентрации 1 моль/л. Величины ав для некоторых природных местообитаний приведены на рис. 6.2.
В соответствии с различиями между условиями «сухости» варьируют и молекулярные механизмы адаптации к ним микробов. Наиболее распространенная на Земле природная среда —это морская вода; она содержит примерно 3% КаС1, а также небольшое количество других неорганических веществ. Большинство морских микроорганизмов нуждается в повышенной концентрации Nа+, и поэтому они названы галофилами. Некоторые бактерии способны расти в средах с высоким содержанием соли, но не нуждаются в ней — это галотолерантные организмы. Степень галофилии варьирует у бактерий от низкой (1-6%) и средней (6-15%) до экстремальной (15-30%). При низкой активности воды, как правило, микроорганизмы не выживают, и благодаря этому засолка, сушка или добавление сахара предохраняет пищевые продукты от порчи. Для большей части бактерий предпочтительны значения, ав 0,98-0,99. Организмы, растущие в средах с высоким содержанием сахара, называют осмофилами; растущие в очень сухих (из-за отсутствия воды) средах — ксерофилами. При выращивании морских бактерий высокое осмотическое давление среды обычно создают добавлением солей (NаС1, КС1, Nа2SО4; искусственная морская вода). Необходимо учитывать, однако, что многие ионы в повышенных концентрациях могут оказывать вредное воздействие.
2.8.Давление не оказывает
существенного влияния на рост бактерий
При изучении влияния гидростатического давления на рост бактерий были получены неожиданные результаты: оказалось, что изменение давления в диапазоне 0-100 бар (0-10 МПа) не оказывает никакого эффекта на рост большинства бактерий или же его влияние незначительно. Тем не менее барофильные бактерии, обитающие в морских глубинах, не только адаптированы к высокому давлению, характерному для этих местообитаний, но и нуждаются в нем (например, в давлении 600 бар на 6000-метровой глубине). Для изучения глубоводных микроорганизмов требуется сложное оборудование, позволяющее поддерживать высокое давление.
Природные местообитания.
Многие природные среды содержат растворенный кислород в незначительном количестве, не содержат кислорода вообще или становятся анаэробными на определенные промежутки времени. Анаэробные условия возникают в случае, если О2 потребляется микроорганизмами и при этом диффузия его ограничена. Кроме того, концентрация молекулярного кислорода может падать в результате его восстановления характерными для анаэробов конечными продуктами метаболизма, такими как Н2S.
Анаэробы.
Микроорганизмы, способные расти как в присутствии, так и в отсутствие кислорода, называют факультативными анаэробами. К микроаэрофилам относят те организмы, которые нуждаются в кислороде для дыхания, но растут только при низком содержании его в среде. Анаэробы не способны осуществлять дыхание с участием О2; одни из них могут расти в присутствии кислорода и устойчивы к нему (аэротолерантные бактерии), другие же — облигатные (строгие) анаэробы — погибают при контакте с О2 или по крайней мере растут в его присутствии очень слабо. Метаболизм облигатно анаэробных бактерий приспособлен к средам с низким значением окислительно-восстановительного потенциала, и некоторые их ферменты чувствительны к кислороду. Таким образом, рост строгих анаэробов возможен только в отсутствие кислорода и при восстановительных условиях [окислителыю-восстановительный потенциал среды (Е0) должен быть отрицательной величиной].
Удаление кислорода.
Для уменьшения содержания кислорода в среде ее вначале кипятят. Оставшийся О2 удаляют пропусканием через среду газа, например очищенного от кислорода N2 или смёси N2/СО2. После этого в среду добавляют восстановитель и сосуд герметически закрывают. Восстановитель поддерживает окислительно-восстановительный потенциал среды, аналогично тому, как буфер регулирует ее рН. В качестве восстановителей для этого используют Nа2S, FеS, дитионит, органические тиоловые соединения, такие как тиогликолат и цистеин, или цитрат титана (Ш). Величина Е'0 этих соединений варьирует приблизительно от —0,2 В (цистеин) до —0,5 В [Т1(Ш)]. Под действием восстановителя О2 восстанавливается до Н2О, и таким образом восстановитель функционирует как окислительно-восстановительный буфер. Следы кислорода из газов удаляют путем абсорбции или добавления к газу Н2 (~5%), который при участии катализатора (палладий) реагирует с О2, в результате чего образуется вода. Значение окислительно-восстановительного потенциала среды удобно контролировать, добавляя в среду следовое количество нетоксичного, окрашенного в окисленном состоянии, самоокисляющегося красителя, который становится бесцветным в восстановленной форме. Значение Е'0 для наиболее часто используемых красителей такого рода варьирует от 0 В (метиленовый синий, резазурин) до —0,25 В (феносафранин). Следовательно, если резазурин не окрашен при рН 7,0, значение Е' среды меньше 0 В, т. е. она подходит для роста строгих анаэробов.
3.0.Светможетслужитьисточникомэнергии длямикроорганизмов, ноодновременно оказываетповреждающеедействие.
Фототрофные прокариоты используют свет того или иного участка спектра и определенной интенсивности в качестве источника энергии. В то же время свет высокой интенсивности может оказывать ингибирующее действие и на фототрофные, и на нефототрофные микроорганизмы в результате фотохимических реакций. У фототрофов защиту от повреждающего действия света обеспечивают те же пигментные системы, которые участвуют в фотосинтезе; защитные пигментные системы обнаружены также у многих нефототрофных организмов.
3.1.Среды для выращивания бактерий содержат все необходимые питательные вещества.
Помимо соответствующих физико-химических условий среды, бактериям необходимы для роста источники энергии и всех элементов, из которых состоят компоненты клеток. «Узкоспециализированные» бактерии нуждаются в строго определенных питательных веществах, тогда как «малоспециализированные» способны использовать широкий набор питательных веществ.
Бактерии-прототрофы могут расти на простых средах, содержащих одно вещество в качестве источника углерода и энергии, а также несколько неорганических солей для обеспечения потребности в других элементах. В отличие от этого рост ауксотрофов зависит от присутствия в среде готовых клеточных компонентов — либо витаминов в следовых количествах в качестве предшественников коферментов и простетических групп, либо (в большем количестве) аминокислот или других органических соединений, входящих в состав клеточных полимеров или представляющих собой важные растворимые вещества. У многих микроорганизмов потребности в питательных веществах изучены пока недостаточно, и их удается культивировать лишь в средах, содержащих сложные природные компоненты, такие как сыворотка крови, жидкость рубца, дрожжевой автолизат или пептоны. Некоторые облигатно паразитические или сим-биотические бактерии не способны, по-видимому, расти вне живого организма-хозяина. Подобно этому некоторые анаэробные бактерии, сбраживающие «низкоэнергетические» субстраты, растут лишь в присутствии партнера — синтрофного организма, который потребляет продукты брожения благодаря функционированию специальных метаболических путей.
В наибольшем количестве для роста необходимы источники энергии, электронов и углерода плюс акцепторы электронов.
3.2.Источники энергии.
Основной источник энергии на Земле — это солнечный свет; среди прокариот его способны использовать фототрофные бактерии, цианобактерии и некоторые археи. Микроорганизмы, не использующие свет, получают энергию для роста путем окисления или сбраживания химических веществ (хемотрофы). Для окисления, как правило, необходим О2 в качестве акцептора электронов, но многие бактерии способны к анаэробному дыханию. Таким образом, для роста бактерий, осуществляющих дыхание, необходимо присутствие в среде кислорода или другого окислителя.
Доноры электронов.
В качестве доноров электронов для дыхания и биосинтеза литотрофные микроорганизмы используют неорганические соединения, органотрофные микроорганизмы — органические вещества.
Источники углерода.
Для гетеротрофов источником клеточного углерода служат органические соединения. Автотрофы при наличии источников энергии и восстановителей используют в качестве единственного источника углерода СО2. Тем микроорганизмам, которые не обладают способностью использовать энергию света, требуется при этом органический или неорганический субстрат в качестве донора электронов и источника энергии. Бактерии, осуществляющие дыхание, нуждаются, кроме того, в акцепторе электронов.
3.3.Основными питательными элементами служат углерод, азот, сера и фосфор.
Всем бактериям для синтеза компонентов клеток необходимы углерод, азот, сера и фосфор. Эти элементы вместе с Н и О входят в состав клеточных полимеров. Потребность в них можно рассчитать количественно, зная элементный состав клетки. Он приблизительно соответствует формуле С2Н7О1,5N плюс небольшое количество Р, S, Fе, щелочных и щелочноземельных металлов, а также следовое количество микро-элементов. Источником углерода, составляющего 50% сухого вещества клеток, обычно служат те же органические соединения, которые используются как источники энергии. Аэробные микроорганизмы, как правило; включают в состав клетки примерно 50% органического субстрата—намного больше, чем бактерии, осуществляющие брожение (10-20%). Остальное количество органического субстрата клетки используют в качестве источника энергии. Все встречающиеся в природе органические вещества можно рассматривать как потенциальные субстраты для роста микроорганизмов; при этом предпочтительным для многих бактерий источником углерода служит глюкоза — наиболее распространенное органическое вещество.
Азот.
Составляющий 14% сухого вещества клеток, входит в состав многих природных соединений; бактерии предпочтительно используют его в форме NН4+". Многие бактерии ассимилируют нитрат, мочевину, аминосахара и аминокислоты; последние обычно добавляют в среду в виде белкового гидролизата — пептона. Немногие бактерии способны усваивать молекулярный азот (N2). Потребляемые окисленные формы азота (например, нитрат) восстанавливаются в Клетках до NНз, который включается в метаболизм.
Источниками серы,
составляющей менее 1% сухого вещества клеток, в большинстве природных
местообитаний служат органические серосодержащие соединения и лишь в морской
воде — сульфат, концентрация которого составляет в ней
Фосфор (3% сухого вещества клеток) встречается в природе обычно в виде фосфатов или фосфорных эфиров. Стабильных (в нормальных условиях) восстановленных соединений фосфора не существует. Внутри клеток восстановления фосфата не происходит, и он включается в метаболизм именно в этой форме.
Источниками кислорода и водорода, входящих в состав клеточных компонентов, служат для клеток вода и/или органические соединения и лишь в отдельных биосинтетических реакциях гидроксилирования используется молекулярный кислород (атом (Ы.) кислорода из О2 включаются при этом в состав
ОН-группы).
Неорганические соединения используются как минорные, но важные элементы питания.
Для роста микроорганизмов требуются в небольших количествах ионы щелочных металлов (Nа+, К+) и щелочноземельных металлов (М§2+, Са2"1"), необходимые им в качества электролитов и обеспечивающие протекание различных каталитических реакций. Помимо этих металлов, для роста микробов необходим ряд элементов в следовых количествах (их называют микроэлементами), в первую очередь Fе и в меньшем количествеZn, Мn, Со, Мо, Сu, Ni, W, Se, V, В и др.Причем не всем бактериям требуется полный набор этих элементов. Концентрация данных элементов в средах варьирует от миллимолярной (для щелочных и щелочноземельных металлов) до микромолярной (Ре) и меньшей 1 мкМ (10~6-10~8 М для остальных микроэлементов). При более высоких концентрациях микроэлементы оказывают токсическое действие. Большинство двух- и трехвалентных катионов металлов при нейтральном или щелочных значениях рН образуют нерастворимые гидроксиды или фосфаты и становятся недоступными для использования бактериями. Поэтому концентрированные растворы неорганических' солей часто хранят в анаэробных условиях при рН < 7 в присутствии небольших количеств комплексообразующих соединений, таких как ЭДТА или нитрилотриацетат (НТА). Растворимые комплексы с ионами многих металлов способны также образовывать некоторые питательные вещества в составе сред (например, ряд аминокислот — Суз, Н1з — и карбоновых кислот — малат, цитрат). К недостатку металлов в среде, помимо осаждения, приводит Также избыточное хелатирование.
Некоторым бактериям необходимы
витамины для биосинтеза коферментов.
Бактериям, не способным синтезировать те или иные витамины, необходимо присутствие их в среде. Многие бактерии нуждаются лишь в каком-либо одном витамине; так, для роста Е. соliв случае некоторых субстратов требуется витамин В12. Витамины, представляющие собой органические соединения — предшественники или компоненты коферментов либо простатических групп ферментов — и необходимые клеткам в очень небольшом количестве (от 10~6 до 10~7 М), присутствуют во многих природных средах обитания бактерий как продукты разложения биологического материала. Поскольку их биосинтез требует участия многих ферментов, бактериям часто выгоднее не синтезировать их, а поглощать из среды с Помощью высокоаффинных транспортных систем. Минимальные потребности большинства бактерий в витаминах удовлетворяет Добавление в среду дрожжевого экстракта (0,1-0,5%), но предпочтительнее использовать приготовленные в лаборатории растворы витаминов с точно известным составом. Такие растворы, имеющие слабо-кислый рН, стерилизуют фильтрованием и добавляют в среду для выращивания бактерий только после ее автоклавирования; хранят их в стерильном виде, на холоду, в анаэробных условиях и в темноте.
Ауксотрофы нуждаются в аминокислотах или других факторах роста
Аминокислоты и другие факторы роста служат компонентами или предшественниками клеточных макромолекул либо других важных для метаболизма веществ. Присутствие этих веществ в среде, причем в относительно высоких концентрациях (милимолярных), необходимо для роста бактерий, не способных их синтезировать. К факторам роста, помимо аминокислот, относятся, например, пептиды, пиримидины, пурины, (ненасыщенные) жирные кислоты, холестерол, -мевалоновая кислота, холин, бетаин и полиамины. В сыворотке крови или дрожжевом экстракте могут присутствовать неидентифицированные факторы роста.
Среды неопределенного состава дешевле и удобнее в работе.
Изложенные в предыдущих разделах сведения о питательных потребностях микроорганизмов позволяют составлять среды из определенных химических соединений (среды определенного состава, или синтетические среды. Иногда для целей исследования, в первую очередь для выяснения потребностей объекта, используют минимальные среды, содержащие лишь наиболее необходимые для роста компоненты, При-родные среды чаще всего относятся к средам сложного неопределенного состава; для лабораторного культивирования во многих случаях также применяют среды неопределенного состава на основе дешевого пищевого сырья. В качестве источника углерода и энергии в лабораторные среды включают крахмал, солод или мелассу, в качестве источников азота, серы, фосфора и аминокислот — ферментированные, кислотные или щелочные белковые гидролизаты (пептоны из казеина, соевого белка, мяса или рыбы) либо кукурузный экстракт. Для обеспечения аминокислотами, пептидами, водорастворимыми витаминами и углеводами, а также микроэлементами в среды добавляют дрожжевой экстракт, получаемый
автолизом пекарских дрожжей. Для определенных бактерий готовят среды на основе, например, томатного или фруктового сока либо снятого молока. Патогенные микроорганизмы нуждаются в сыворотке крови, бактерии рубца — в жидкости из него. Большинство молочнокислых бактерий выращивают на молоке. Среды определенного состава для тех же бактерий должны содержать примерно 40-50 химических соединений, включая большинство аминокислот, витаминов и микроэлементов.
Дополнительные компоненты сред,
такие как буфер и агар, не используются бактериями в качестве питательных веществ.
Для поддержания на нужном уровне рН в среды добавляют тот или иной буфер, чаще всего фосфатный (рК2= 7), бикарбонат/ССЬ (рК'1 = 6,3) или буфер на основе карбоновой кислоты (уксусной, янтарной или лимонной — рК от 3,1 до 6,4) либо белков (рК 7,0). При использовании для буфера природных органических соединений следует учитывать, что они не должны потребляться бактериями. Широко применяются для добавки в среду синтетические буферы, такие как Трис или «Good!» (цвиттер-ионы органических сульфоновых кислот). Необходимо иметь в виду, что далеко не все буферы инертны — их компоненты мо-гут образовывать либо комплексы с ионами двух и трехвалентных металлов, либо нерастворимые осадки, взаимодействуя с компонентами среды, а также служить питательными веществами для выращиваемых микроорганизмов; фосфат в высокой концентрации подавляет рост многих бактерий.
Для получения плотной среды, в жидкий питательный раствор добавляют агар (0,8% для полужидкой среды, 1,5-2,0%—для плотной). Агар — это полисахарид сложного состава, получаемый из морских красных водорослей; он плавится при температуре 90 °С и после расплавления застывает при температуре 45 °С. Среды для бактерий, растущих при экстремально высокой температуре, высоких концентрациях солей или низких значениях рН либо способных разжижать агар, уплотняют силикагелем. Это неорганическое соединение применяют также для получения плотной среды, если необходимо определить способность бактерии к автотрофному росту.
3.4.Для выращивания чистых культур микроорганизмов необходима стерилизация сред и инструментов
Стерилизацией называют освобождение какого-либо объекта от любых живых организмов. Ниже кратко описаны методы стерилизации и указаны области их применения.
Автоклавирование.
Питательные среды и жаропрочное оборудование обычно стерилизуют текучим паром в автоклаве —15 мин при 121 °С. Такой обработки достаточно для того, чтобы уничтожить клетки и споры бактерий (необходимо помнить, однако, что некоторые экстремофилы могут выживать даже при этих условиях). Указанная температура достигается в автоклаве при давлении насыщенного водяного пара 2 атм. (0,2 МПа). Если в стерилизационной камере имеется воздух, этому давлению соответствует более низкая температура. Чтобы установить требуемый температурный режим стерилизаций, воздух из камеры, прежде чем ее герметизировать, вытесняют паром. По соображениям безопасности в автоклавах обычно установлен только датчик давления, а не температуры, и нужно учитывать, что показание манометра 2 атм. Может не соответствовать температуре 121 °С, если не удален воздух.
Кинетика гибели микробных клеток при таком воздействии подобна кинетике химической реакции первого порядка, т. е. чаще всего имеет характер экспоненциальной зависимости, при которой доля клеток, отмирающих в единицу времени, постоянна. Эффективность стерилизации и чувствительность к ней микроорганизма определяют по времени, необходимому для десятикратного (90%) уменьшения микробной популяции (величина О2)- В качестве индикатора эффективности стерилизации используют чрезвычайно термоустойчивые эндоспоры BacillusStearmophillus, для которых величина D10 при 121 °С равна приблизительно 30.
При работе важно иметь в виду различия в термоустойчивости клёток и спор бактерий, а также то, что с увеличением темпёратуры величина D10 практически экспоненциально снижается и наоборот. Для стерилизации объектов, содержащих большое число эндоспор (например, почвы), необходимы особые условия. Следует также учитывать, что время, которое требуется для уничтожения определенной доли клеток, не зависит от их начальной концентрации.
Пастеризация.
Для многих практических целей достаточно лишь существенно уменьшить количество жизнеспособных микроорганизмов в объёкте путем выдерживания его при 65-75 °С в течение короткого времени (минут). При такой обработке погибает большинство патогенных бактерий и срок хранения продуктов, например молока, возрастает. Молоко прогревают при 71-74 °С в течение 20 с, консервируемые продукты — 20 мин при 80 °С. Необходимо помнить, что такая обработка не равнозначна стерилизации, поскольку споры при этом не погибают; однако во многих консервированных продуктах их прорастания не происходит благодаря тому, что эти продукты имеют кислую реакцию.
Стерилизация сухим жаром.
При действии сухого жара споры бактерий выдерживают более высокую температуру, чем при стерилизации паром. Поэтому посуду, инструменты и все остальные используемые при работе с чистыми культурами предметы стерилизуют в сушильном шкафу при температуре 160 °С в течение 2 ч или при 180 °С в течение 30 мин.
Фильтрование.
Водные растворы термолабильных или летучих веществ для внесения их в среды (после автоклавирования) стерилизуют фильтрованием. При небольших объемах жидкости применяют предварительно простерилизованные насадки на колбы Бухнера, помещая в них мембранные фильтры с диаметром пор 0,2-0,45 мкм. Для фильтрования больших объемов используют различные специальные системы, например на основе толстых пористых трубок из фарфора или кизельгура (диатомита).
Облучение.
Для стерилизации в промышленных масштабах применяют рентгеновское или гамма-излучение, а также другие виды ионизирующей радиации. В исследовательских лабораториях и медицинских учреждениях рабочие места и помещения стерилизуют ультрафиолетом.
3.5.Рост можно измерять различными методами.
Рост бактерий означает деление клеток и; следовательно, увеличение их общего количества. Соответственно одним из основных методов измерения роста служит прямой подсчет числа клеток под микроскопом. Однако этот метод не позволяет различать живые и мертвые клетки, и, кроме того, в природных образцах при его использовании иногда трудно отличить мелкие клетки от других частиц. Поэтому во многих случаях, например при низкой плотности клеток в пробах, для измерения роста определяют число клеток, образующих колонии (колониеобразующие единицы, КОЕ). Часто рост определяют по приросту биомассы. Этот способ наиболее пригоден, в частности, для организмов, образующих мицелий, нити или скопления клеток. В качестве показателя роста культур в жидкой среде измеряют светорассеяние, или мутность. При промышленном культивировании показателем роста во многих случаях служит потребление субстрата (например, О2) или образование продуктов обмена (например, СО2 или кислот), пропорциональное росту культуры.
Турбидиметрия.
Размеры
бактериальных клеток относятся к тому же порядку величин, что и длины волн
видимого света, поэтому бактериальные суспензии довольно значительно рассеивают
свет, т. е. имеют мутность. Величину светорассеяния можно измерить с помощью спектрофотометра.
Этот прибор позволяет определить долю падающего света, которая при его
прохождении через пробу теряется в результате рассеяния и поглощения света. Для
измерений используют кюветы одной и той же толщины, чтобы можно было сравнивать
результаты. Поглощение связано с интенсивностью падающего (Iо) и пропускаемого (I) света зависимостью А = 1оg(Iо/I). Соотношение между концентрацией раствора и поглощением,
известное как закон Ламберта-Бэра, А = е • с • d, применимо в строгом смысле только к не рассеивающим
свет растворам. Тем не менее существует линейная зависимость между
«поглощением» (А) и количеством клеток бактерий в суспензии N : А = (d • N) в диапазоне величин А < 0,3.
Обычно для измерения роста используют длины волны от 500 до 660 нм, поскольку большинство
компонентов клеток не поглощает свет этой области спектра (длину волны
указывают нижним индексом, например, А660) Показания прибора за вычетом величины
поглощения кюветы с чистой средой (контроль) называют оптической плотностью, ОD (при толщине кюветы
Светорассеяние зависит не только от количества частиц в суспензии, но также от их размеров и формы. Тем не менее, разбавленные суспензии большинства бактерий независимо от размеров клеток характеризуются почти одинаковым поглощением в расчете на концентрацию сухого вещества. Для перевода показаний спектрофотометра в значения биомассы используют калибровочную кривую, показывающую зависимость оптической плотности культуры от концентрации биомассы (высушенных клеток). Таким образом, Турбидиметрия служит высокоточным и удобным методом непрямого определения биомассы. Однако следует учитывать, что величины поглощения света суспензиями отдельных бактерий с клетками разных размеров могут быть различными.
Реже для определения биомассы используют нефелометрию —- измерение светорассеяния под углом 90 ° к падающему пучку света. Обратите внимание, однако, что большая часть света рассеивается лишь на небольшой угол, 2-12 °. Это высокочувствительный метод, но он может давать ошибочные результаты при наличии в среде примесей в виде частиц. Для точности измерений нефелометр необходимо часто калибровать.
Определение биомассы.
Турбидиметрия как способ определения биомассы в ряде случаев
неприменима (для культур с мицелиальным или поверхностным ростом, для бактерий, образующих длинные нити, агрегаты и скопления клеток, а также для смешанных культур, в которых варьирует количественное соотношение видов); измерение количества сырой биомассы дает обычно весьма неточные результаты. В связи с этим для измерения биомассы определяют массу высушенных клеток. Отцентрифугированную (или отфильтрованную) и промытую водой биомассу высушивают до постоянного веса в сушильном шкафу при 105 °С. Другим способом сушки служит лиофилизация. Сухое вещество клеток составляет обычно 10-20% их сырой массы. Количество биомассы можно также оценить косвенно по содержанию белка в культуре. Для этого клетки осаждают кислотой, после чего определяют белок с помощью колориметрического метода. Соотношение биомассы клеток и количества в ней белка постоянно только при, сбалансированном росте, т. е. когда состав клеток по мере роста культуры не претерпевает изменений. Однако в большинстве случаев это соотношение изменяется в конце экспоненциальной фазы роста, а также при образовании бактериями большого количества запасных веществ. Способом измерения роста может также служить определение содержания С или N в биомассе.
Метаболические параметры, пропорциональные росту.
Если рост культуры относительно сбалансированный и метаболизм не разобщен с биосинтезом, увеличение биомассы удобно контролировать по поглощению субстратов (например, О2 или источника углерода) либо по образованию продуктов обмена (например, СО2). Концентрацию газов наиболее просто определить на входе и выходе культиватора с помощью масс-спектрометра, инфракрасного абсорбционного спектроскопа или другого прибора. Зная экономический коэффициент (отношение массы клеток к количеству потребленного субстрата) и метаболические параметры роста, можно оценить увеличение биомассы.
3.6.Подсчет колоний.
Этот широко применяемый метод позволяет определять количество жизнеспособных клеток, образующих на плотной среде видимые колонии. На получаемые результаты может, однако, влиять изменение в состоянии клеток при инкубации в новых условиях и, кроме того, при использовании этого метода могут оказаться неучтенными покоящиеся формы бактерий. Как правило, перед посевом готовят серийные разведения культуры, например в физиологическом растворе, содержащем фосфатный буфер. Если культура густая, делают несколько 10- или 100-кратных разведений, поскольку количество жизнеспособных клеток в пробе заранее не известно. Напротив, разбавленные пробы, например из природных водоемов, содержащие незначительное число бактерий, концентрируют фильтрованием или иногда центрифугированием. Посев производят поверхностным или глубинным способом. При поверхностном посеве инокулят в виде суспензии клеток объемом 0,1 мл наносят на поверхность застывшей агаровой среды. При глубинном посеве вносят 0,1-1,0 мл инокулята в еще не застывшую среду, после чего ее перемешивают и разливают по чашкам Петри (предполагается, что кратковременное пребывание клеток в расплавленной агаровой среде, при 45 °С не влияет на их жизнеспособность, но это необходимо проверять). Анаэробные бактерии, для подсчета клеток выращивают во вращаемых пробирках: пробирки с небольшим количеством расплавленной агаризованной среды, закрытые пробками, вращают в горизонтальном положении на холоду, в результате чего агар застывает в виде тонкой пленки на стенках пробирки. Другой способ учета анаэробных бактерий —это посев в двухслойный агар; бактерии высевают на агаризованную среду в чашках Петри и поверх нее наносят тонкий слой полужидкого агара. Развитие небольших, компактных колоний происходит под его поверхностью. Для анаэробов используют также посев в тонкий слой агара: инокулят вносят в небольшое количество расплавленного и остуженного полужидкого агара (0,75%), который выливают затем в чашку Петри с плотной средой. Подсчет колоний производят обычно в тех чашках (или вращаемых пробирках), в которых содержится от 30 до 300 колоний. Для достоверности результатов необходимо подсчитать несколько сотен колоний. При статистической обработке данных определяют стандартное отклонение как квадратный корень числа подсчитанных колоний. Каждый из этих методов предполагает контроль эффективности посева с помощью прямого подсчета числа клеток (см. ниже); эта эффективность должна быть близка к 100%. Кроме того, следует проверять, что клетки в инокуляте не образуют скоплений. Результаты количественного учета клеток
обычно выражают в колониеобразующих единицах.
Для определения численности бактерий в сильно разбавленных пробах (например, питьевой воде) рекомендуется использовать метод подсчета колоний на мембранных фильтрах. Пробы фильтруют через мембранные фильтры с необходимыми размерами пор, после чего фильтр помещают на агаризованную среду или просто на фильтровальную бумагу, пропитанную питательной средой. Колонии образуются на поверхности фильтра благодаря проникновению через него питательных веществ из среды. Недостаток всех описанных методов состоит в том, что многие бактерии могут быть высокочувствительными к некоторым компонентам агара. Посев для подсчета колоний можно объединить с физиологическими тестами, используя индикаторный агар.
3.7.Метод определения наиболее вероятного числа бактерий (метод предельных разведений).
Этот способ позволяет провести грубый подсчет числа жизнеспособных клеток. Он состоит в том, что приготавливают несколько последовательных разведений культуры в ростовой среде и после инкубации подсчитывают число пробирок, в которых отсутствует рост. Предполагается, что в эти пробирки при посеве не было внесено ни одной жизнеспособной клетки. Принимая, что распределение клеток описывается формулой Пуассона, среднее число клеток т в данном разведении вычисляют по формуле
т = -1пР0, (6.11)
где ро — отношение количества пробирок, в которых отсутствует рост, к общему числу пробирок в данном разведении. Затем среднее значение умножают на фактор разбавления и корректируют с учетом объема инокулята, чтобы вычислить число жизнеспособных клеток в исходной культуре. Этот метод более трудоемок по сравнению с методами прямого подсчета, но его приходится использовать, если микроорганизм не растет на плотных средах. Кроме того, он позволяет учесть организмы, растущие медленнее других, если они находятся в одной пробе с быстрорастущими формами. Наиболее важное преимущество этого метода состоит в том, что в тех образцах, где, помимо исследуемых, присутствуют иные организмы, он позволяет выявить интересующий объект, например с помощью микроскопии или по образованию характерных продуктов (например, сероводорода бактериями сульфатредукторами; в присутствии Н2S и Fе(П) образуется черный осадок FеS). Кроме того, можно исключить контаминирующие бактерии, применяя селективные среды.
Прямой подсчет.
Количество микробных клеток можно подсчитывать
непосредственно под микроскопом с помощью счетной камеры, представляющей собой
специальное предметное стекло с небольшой выемкой известной глубины (обычно
В природных условиях измерять рост бактерий довольно сложно. Обычно для этого используют косвенные методы, такие как определение фиксации 14СО2 или [3Н]-тимидина. Кроме того, проводят прямой подсчет числа клеток с использованием флуоресцентного микроскопа, окрашивая клетки флуоресцентными красителями (например, 4',6-диамидино-2-фенилиндолом, ДАФИ) или обрабатывая их флуоресцентными ДНК-зондами.
4.0. Методыхранениякультуробеспечивают
длительноеподдержаниеихжизнеспособности
Основные цели хранения культур — это поддержание жизнеспособности клеток и чистоты культуры, а также предотвращение изменений и мутаций, т. е. сохранение микроорганизма в максимально близком к исходному штамму состоянии. Для хранения важен правильный выбор среды и метода культивирования, а также возраста культуры на момент начала хранения.
Методы непродолжительного хранения лишь частично удовлетворяют этим критериям. Из таких методов чаще всего применяется периодический пересев культур на свежую среду с выращиванием при низкой температуре и последующим хранением в холодильнике. Культуры споровых бактерий, содержащие зрелые споры, можно хранить сухими в стерильной почве, на стерильной фильтровальной бумаге или в виде культур, высушенных при помощи силикагеля. Некоторые бактерии хорошо переносят хранение в высушенных каплях желатина. Для многих целей хранят клетки в жизнеспособном состоянии в течение лет при температуре —20 °С или, что лучше, при —70 °С (глубокое замораживание). Для хранения с помощью этих методов необходимо использовать культуры в середине или в конце экспоненциальной фазы роста, сконцентрированные и затем ресуспендированные в небольшом количестве свежей питательной среды. При замораживании в среде должны присутствовать криопротекторы, такие как глицерол (15-40 об. %) или диметилсульфоксид (ДМСО, 5-10 об. %), предохраняющие клетки от повреждения замораживанием, которое должно происходить со скоростью 1 °С/мин. Оттаивание замороженных культур рекомендуется производить в более быстром режиме.
В настоящее время широко применяются методы длительного хранения, основанные на лиофилизации или ультразамораживании культур в жидком азоте (—196 °С) либо над жидким азотом (—150 °С). Для оценки эффективности этих методов их сравнивают по доле выживших клеток после определенного времени хранения. Ожидаемый период выживания бактерий при обоих способах длительного хранения превышает 40 лет, в то время как при глубоком замораживании он составляет 1-3 года. При ультра-замораживании к суспензии обычно добавляют криопротекторы, такие как глицерол (10 об. %) или ДМСО (5 об. %). Эти соединения водорастворимы и способны легко проходить через клеточную мембрану, имеют низкую точку плавления и могут замещать воду в качестве гидратной оболочки, уменьшая таким образом повреждающее влияние дегидратации при замерзании воды. Поэтому замораживание и образование кристаллов льда в среде протекает замедленно. Происходящее при этом возрастание концентрации внеклеточного раствора приводит к тому, что вода начинает выходить из клеток. По мере замораживания вся свободная вода кристаллизуется (в виде чистого льда), оставляя концентрированный раствор, замерзание которого приводит к образованию лишь незначительного количества повреждающих клетку кристаллов.
Лиофилизация заключается в удалении воды из замороженных клеток путем сублимации при низком давлении; при этом вода испаряется без перехода в жидкую фазу. Лиофильно высушенные клетки сохраняют жизнеспособность в течение длительного времени, если защищены от действия кислорода, влаги, высокой температуры и света. При лиофилизации к суспензии часто добавляют криопротекторы, такие, например, как молочная сыворотка (20%, вес/объем), лошадиная сыворотка (10 об. %), сахароза (12%, вес/объем) или другие химические вещества.
4.1.Работамикробиологовосновананаметодах
элективногокультивированияиполучениячистыхкультур
До сих пор мы рассматривали методы выращивания и поддержания имеющихся культур бактерий. Однако для решения многих проблем научного и прикладного характера необходимы поиск в природе и выделение новых видов с ранее не описанными свойствами. При этом используют метод накопительных культур, введенный в практику более 100 лет назад С. Н. Виноградским и М. Бейеринком.
Принцип методов выделения.
В большинстве природных образцов в одном грамме материала присутствуют сотни различных видов бактерий, и тем не менее среди них можно не найти искомого. Чтобы выделить желаемый микроорганизм, важно иметь подходящий материал из соответствующего местообитания. Например, экстремально термофильные бактерии с большой вероятностью можно выделить из воды горячих источников, анаэробные — из иловых отложений. В природе происходит естественное обогащение сред теми или иными микроорганизмами, если имеется постоянный приток специфического субстрата и относительно постоянные условия, По аналогии с этим метод накопительных культур основан на подборе селективной (элективной) среды — благоприятной для искомого организма и неблагоприятной для других, а также селективных физико-химических условий культивирования. К сожалению, при использовании такого метода в накопительной культуре, как правило, доминируют быстрорастущие виды, которые подавляют все остальные формы. Медленнорастущие виды удается выделить только в том случае, если своевременно пересевать пробы из накопительной культуры на плотную среду в чашках Петри. Можно также высевать непосредственно природные пробы на плотную элективную среду, где медленнорастущие виды при длительной инкубации образуют видимые колонии.
Селективные условия создают путем комбинирования различных источников энергии, углерода и других элементов (N, Р, S и т. д.) плюс доноров и акцепторов электронов, путем внесения в среду ингибиторов, варьирования освещенности, концентрации кислорода, температуры, рН, активности воды, солености и т. д., а также концентрации компонентов среды и спектрального состава света.
Чистые культуры, или клоны, получаемые из одной клетки, выделяют в большинстве случаев с помощью методов, описанных в разд. 6.5 как способы измерения роста путем подсчета колоний. Простейший способ получения колоний — это посев проб из накопительной культуры на поверхность плотной питательной среды истощающим штрихом или в расплавленную и остуженную агаризованную среду, разливаемую затем в чашки Петри либо пробирки. Среди выросших колоний выбирают полностью изолированные от других и тем же способом высевают их в виде суспензии на аналогичную среду. Если все колонии из второго пересева выглядят одинаково, их можно использовать далее для посева в жидкую среду (при этом также нужно брать изолированную колонию). Однако бактерии, способные к быстрому движению, в особенности спирохеты, могут легко распространяться по влажной поверхности среды и контаминировать чашку. Другой способ выделения — это последовательное разведение клеточной суспензии питательной средой в соотношении 1 : 2 (или 1 : 10, 1 : 100; метод предельных разведений), с тем допущением, что последнее из разведений, где будет наблюдаться рост, исходно содержало лишь одну бактериальную клетку. Этот метод используют, если выделяемый организм количественно преобладает в накопительной культуре. В случаях, когда нельзя использовать ни высев на плотные среды, ни разведение пробы в жидкой среде, чистую культуру можно получить из отдельной бактериальной клетки, отобранной под микроскопом с помощью капиллярной пипетки и микроманипулятора. Все этапы выделения необходимо производить в нескольких повторностях и проверять чистоту выделенных колоний или культур по всем необходимым критериям.
Непрерывноекультивированиеслужит ценныминструментомисследования
Роствхемостате.
Скорость роста бактерий может изменяться в соответствии с условиями и составом среды, например в ответ на сдвиг в концентрации субстрата. Это свойство бактерий наглядно иллюстрирует хемостатная (непрерывная) культура. При непрерывном культивировании, в отличие от периодического, в культиватор постоянно подается свежая питательная среда и концентрация одного из субстратов поддерживается на уровне, лимитирующем рост. Одновременно происходит постоянный отток культуры, так что объем ее в культиваторе не изменяется. Культиватор снабжен мешалкой для равномерного распределения свежей среды.
Хемостатная
культура обладает двумя неожиданными свойствами. Во-первых, при постоянном
притоке свежей среды плотность клеток в ней сохраняется на постоянном уровне,
и, во-вторых, стационарная концентрация клеток N остается практически
неизменной даже при больших изменениях скорости протока (Е; размерность
объем/ед. времени, например л/ч). Однако при скорости протока выше
определенного значения стационарная концентрация клеток начинает резко падать,
достигая нуля при критической скорости протока, соответствующей максимальной
удельной скорости роста 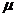 мах периодической культуры того же организма. Остаточная
концентрация субстрата в культуре обычно очень низка, но возрастает
гиперболически с увеличением скорости протока, пропорционально падению
концентрации клеток.
мах периодической культуры того же организма. Остаточная
концентрация субстрата в культуре обычно очень низка, но возрастает
гиперболически с увеличением скорости протока, пропорционально падению
концентрации клеток.
-Культивирование в хемостате.
- обеспечивает постоянное получение молодых клеток, выросших в строго определенных условиях при известной удельной скорости роста; такие клетки необходимы для изучения различных регуляторных процессов;
- позволяет определять важные показатели
роста, такие как Кs, /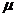 mах,
ms и любые
другие, связанные с
mах,
ms и любые
другие, связанные с 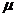 , а также изучать физиологическую реакцию
культуры на лимитирование питательными веществами;
, а также изучать физиологическую реакцию
культуры на лимитирование питательными веществами;
- служит полезной моделью для описания роста во многих природных местообитаниях;
- позволяет выявлять предпочтительно используемые субстраты в их смеси, а также конкуренцию или сосуществование двух или трех видов при данных условиях роста;
- позволяет проводить подпитку токсичными субстратами в более высоких концентрациях;
- обеспечивает отбор мутантов с более низким
значением Кsлимитирующего рост субстрата или более высоким значением 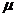 mах;
mах;
- позволяет исследовать стабильные двухкомпонентные культуры, также как синтрофные ассоциации, или, например, простейших, питающихся бактериями.
4.2.Полунепрерывноекультивирование
Этот способ культивирования,
называемый также периодическим культивированием с подпиткой, состоит в том, что
в периодическую культуру непрерывно добавляют основной питательный субстрат,
экспоненциально увеличивая скорость его подачи. Таким путем удлиняют экспоненциальную
фазу роста, чтобы можно было периодически отбирать часть культуры для ее использования.
Полунепрерывное культивирование применяют, например, в тех случаях, когда субстрат
в высоких концентрациях токсичен. При таком способе удается получать больший
урожай клеток или выход продукта, чем при обычном
периодическом
культивировании, и для этого не требуется много Дополнительного оборудования.
Таким образом, обеспечивая культуру основными питательными веществами в
возрастающем количестве соответственно ростовым потребностям микроорганизма, но
не создавая их избытка, в периодической культуре удается достичь очень высокой
плотности клеток (до
4.3.Методыконсервированияоснованынаподавлениимикробногороста
Физические факторы.
Любой фактор, влияющий на скорость роста бактерий, при его экстремальном уровне оказывает ингибирующее действие (исключение составляет случай экстремофилов, способных выживать в таких условиях). На практике подобного рода воздействия позволяют консервировать любые органические материалы, например продукты питания, и предотвращать их порчу патогенными, гнилостными или токсинобразующими микроорганизмами. Физические методы обработки включают прогревание или замораживание, подкисление, высушивание, засолку или добавление большого количества сахара для понижения доступности воды. Неблагоприятный эффект экстремальных температур, значений рН или осмолярности повышается при удалении из среды кислорода. На применении этих факторов основаны традиционные методы консервирования продуктов питания.
Химическая обработка.
В качестве ингибиторов роста микроорганизмов могут применяться некоторые безопасные для человека химические вещества в низких концентрациях. Например, при добавлении газообразного SО2 в воду образуется сернистая кислота (Н2SОз; рК1 = 2; рК2 = 7), которая в протонированной форме проникает через клеточную мембрану и как восстановитель (окисляясь до Н2SО4) расщепляет —S—S-связи с образованием —S—SО3- +НS-. Это позволяет использовать SС2 для консервирования кислых продуктов, таких как вино или сухие фрукты, если их рН < 3,5-4. Бактериальный рост может быть предотвращен добавлением слабых органических кислот или их образованием микробами insitu, если значение рН среды поддерживается на низком уровне. Последнее необходимо для того, чтобы кислоты преимущественно находились в протонированной форме, способной проникать сквозь клеточную мембрану. В качестве таких ингибиторов используют молочную, муравьиную, пропионовую, лимонную, виннокаменную, бензойную и сорбиновую кислоты. Эфиры бензойной кислоты легко проникают через мембрану при нейтральном рН и внутри клеток расщепляются эстеразами. Благодаря этому они используются как добавки для консервирования продуктов питания, имеющих нейтральную или щелочную реакцию. Если не исключен доступ воздуха, консервируемые кислотами продукты могут портиться под действием дрожжей и грибов. Этиловый спирт при высоком содержании также предотвращает микробный рост. Такие обладающие антимикробным действием соединения, как фенолы, метилфенолы (крезолы), альдегиды и другие, менее безопасные соединения, содержащие в дыме, воздействуют на пищевые продукты при копчении.
Антимикробные агенты, более сильнодействующие по сравнению с теми, которые используются для консервирования, находят применение в других областях. К таким ингибиторам относятся соли тяжелых металлов (например, сулема НgСl2), хлорноватистая кислота (НОСl), бром, йод, детергенты (мыло) и органические растворители, а также разнообразные синтетические и природные антибиотики.
Список литературы:
1. Современная микробиология под редакцией Й. Ленгелера, Г. Древса,
Г. Шлегеля ; Москва, 2005, - 288с.
2. Общая микробиология под редакцией Л. В. Алексеевой и Е. Н. Кондратьевой, - Москва 1987, - 566с.
3. Метаболизм бактерий Гусев М.В. Минсева Л.А. Москва, 1992, - 384с.
4. Экология бактерий Громов Б.В. Павленко Г.В. Ленинград (Санкт-Петербург). – 328с.