Тонкослойная хроматография. Применение в фармации
| Загрузить архив: | |
| Файл: ref-26937.zip (75kb [zip], Скачиваний: 231) скачать |
МЗРФ
ДВГМУ
Кафедра общей, физической и коллоидной химии
Реферат
Тонкослойная хроматография. Применение в фармации
Выполнил: студент группы 201-Ф
Данилов Д. И.
Проверил: Немов В. А.
г. Хабаровск, 2005
ПЛАН:
Введение
Физико-химические основы ТСХ
Распределительная хроматография на бумаге
Основы тонкослойной хроматографии
- сорбенты
- растворители
- подготовка пластин
- техника нанесения исследуемых растворов
Хроматографирование
·
·
·
·
Сушка пластин.
Идентификация разделенных веществ
Применение метода ТСХ в фармации
- Количественное определение тритерпеновых сапонинов методом ВЭТСХ с использованием сканирующей денситометрии
- Изучение липидного и флавоноидного состава образцов некоторых видов рода Чина (Lathyrus.)
Заключение
Литература
Введение
Тонкослойная хроматография
(ТСХ, TLC) - один из наиболее используемых методов хроматографического анализа,
но наименее популяризируемый.
Несмотря на
существовавшие до недавнего времени существенные недостатки, она широко
используется для качественного анализа смесей, в основном, за счет дешевизны и
скорости получения результатов. Тонкослойная
хроматография (ТСХ) первоначально была разработана для разделения липидов. Хотя
хроматография на бумаге быстрее, чем хроматография на колонке, к недостаткам ее
следует отнести то, что бумага может быть изготовлена только из материалов на
основе целлюлозы, что не позволяет применять ее для разделения неполярных
веществ. Тонкослойная хроматография сохраняет все преимущества хроматографии на
бумаге, но при этом позволяет использовать любой материал, который можно тонко
измельчить и получить затем однородный слой. Это могут быть неорганические
вещества, например силикагель, окись алюминия, диатомовая земля и силикат
магния, а также органические вещества, в частности целлюлоза, полиамиды и
порошок полиэтилена.
Физико-химические основы тонкослойной хроматографии.
Основой
тонкослойной хроматографии является адсорбционный метод, хотя также встречается
метод распределительной хроматографии.
Адсорбционный
метод основан на различии степени сорбции-десорбции разделяемых компонентов на
неподвижной фазе. Адсорбция осуществляется за счет ван-дер-вальсовских сил,
являющейся основой физической адсорбции, полимолекулярной (образование
нескольких слоев адсорбата на поверхности адсорбента) и хемосорбцией
(химического взаимодействия адсорбента и адсорбата).
Для эффективных
процессов сорбции-десорбции необходима большая площадь, что предъявляет
определенные требования к адсорбенту. При большой поверхности разделения фаз
происходит быстрое установление равновесия между фазами компонентов смеси и эффективное
разделение.
Еще одним видом
используемом в методе тонкослойной хроматографии является распределительная
жидкостная хроматография.
В распределительной
хроматографии обе фазы - подвижная и неподвижная - жидкости, не смешивающиеся
друг с другом. Разделение веществ основано на различии в их коэффициентах
распределения между этими фазами.
Впервые метод
тонкослойной хроматографии заявил о себе как "Бумажная тонкослойная
хроматография", которая основывалась на распределительном методе
разделения компонентов.
Распределительная хроматография на бумаге.
В связи с тем,
что используемая в этом методе хроматографическая бумага (специальные сорта
фильтровальной бумаги) содержат в порах воду (20-22%), в качестве другой фазы
используются органические растворители.
Использование
хроматографии на бумаге имеет ряд существенных недостатков: зависимость
процесса разделения от состава и свойств бумаги, изменение содержания воды в
порах бумаги при изменении условий хранения, очень низкая скорость
хроматографирования (до нескольких суток), низкая воспроизводимость
результатов. Эти недостатки серьезно влияют на распространение хроматографии на
бумаге как хроматографического метода.
Поэтому можно
считать закономерным появление хроматографии в тонком слое сорбента -
тонкослойной хроматографии.
Основы тонкослойной хроматографии.
В методе ТСХ
хроматографирование веществ происходит в тонком слое сорбента, нанесенного на
твердую плоскую подложку. Разделение в этом методе в основном происходит на
основе сорбции-десорбции.
Использование
различных сорбентов, позволило значительно расширить и улучшить этот метод.
В начале появления
метода пластины приходилось изготавливать самостоятельно. Но на сегодняшний
день в основном используются пластины заводского изготовления, имеющие
достаточно широкий ассортимент как по размерам и носителям, так и по подложкам.
Современная
хроматографическая пластинка представляет собой основу из стекла, алюминия или
полимера (например политерефталат). В связи с тем, что стеклянная основа
становится менее популярной (часто бьется, нельзя разделить пластинку на
несколько частей не повредив слой сорбента, тяжелая по весу), наибольшее
распространение получили пластины, в качестве основ которых используют
алюминиевую фольгу или полимеры.
Для закрепления
сорбента применяют гипс, крахмал, силиказоль и др., которые удерживают зерна
сорбента на подложке. Толщина слоя может быть различна (100 и более мкм), но
самый важный критерий - слой должен быть равномерный по толщине в любом месте
хроматографической пластинки.
Сорбенты
Наиболее
распространенным сорбентом является силикагель.
Силикагель - гидратированная кремниевая
кислота, образующаяся при действии минеральных кислот на силикат натрия и
сушкой образовавшегося золя. После размалывания золя используют фракцию
определенной зернистости (указанную на пластинке, обычно 5-20 мкм).
Силикагель является
полярным сорбентом, у которого в качестве активных центров служит группы -ОН.
Он легко сорбирует на поверхности воду и образует водородные связи.
Окись алюминия. Окись алюминия является слабо
основным адсорбентом и используется в основном для разделения соединений
слабоосновного и нейтрального характера. Недостатком пластин на окиси алюминия
является обязательная активация поверхности перед использованием в сушильном
шкафу при высокой температуре (100-150 0С) и низкая, по сравнению с
силикагелем адсорбционная емкость слоя.
Кизельгур - адсорбент, полученный из природных
минералов: диатомовых земель. Сорбент обладает гидрофильными свойствами, но
более низкой адсорбционной емкостью слоя по сравнению с силикагелем.
Кремнекислый магний менее полярный чем
силикагель и обычно используется в случаях, когда более полярные адсорбенты не
дали эффективного разделения.
Целлюлоза - тонкослойные пластины с нанесенной
целлюлозой очень эффективны для разделения сложных органических молекул.
Адсорбент представляет собой в основном шарики целлюлозы диаметром до50 мкм,
закрепленные на носителе крахмалом. Но как и в бумажной хроматографии, подъем
фронта растворителя происходит очень медленно.
В ионообменных хроматографических пластинках в
качестве адсорбента используют ионообменные смолы, содержащие четвертичный
аммоний или активные сульфогруппы, участвующие в ионном обмене. Тонкослойная
хроматография с такого типа пластинками, проводится с подвижными фазами
содержащими сильные кислоты или щелочи. Данные пластинки эффективны для
разделения высокомолекулярных и амфотерных соединений.
Вышеперечисленные
сорбенты являются наиболее распространенными, но помимо этих существуют
множество веществ, используемых как сорбенты. Это тальк, сульфат кальция,
крахмал и т.д..
В то же время даже
уже указанные сорбенты могут быть модифицированы для придания им новых
сорбционных свойств (пропитка сорбентов реактивами, например AgNO3,
создание пластин с обращенной фазой). Именно такое разнообразие возможных фаз
при минимальных затратах позволяют использовать ТСХ для хроматографирования
огромного числа веществ.
Растворители
В тонкослойной
хроматографии, в качестве подвижной фазы используют либо чистые вещества
(этилацетат, бензол и т.п.), либо смеси веществ (системы) в определенном
соотношении.
Подбор подвижной
фазы (системы) проводится по следующим правилам:
·
·
·
·
·
·
·
Эти рекомендации дают предварительную оценку выбранной системы. Последнее слово все равно остается за экспериментом.
Подготовка пластин
При
использовании приобретенных пластин, для хроматографирования их необходимо
предварительно подготовить. Это связано с тем, что адсорбенты пластин при
хранении сорбируют не только влагу, но и другие вещества, содержащиеся в
воздухе. При использовании неподготовленных пластин в процессе
хроматографирования появляется фронт "грязи", который может мешать
определению веществ, имеющие большие значения Rf, а некоторые вещества,
например вода, может изменять состав подвижной фазы, изменяя тем самым
получаемые значения Rf.
Предварительная подготовка пластин заключается в разгонке пластин чистым
растворителем на всю высоту пластинки (метанол, бензол, диэтиловый эфир),с
последующей сушкой пластины в сушильном шкафу при температуре 110-120 0С в
течении 0,5-1 часа. Таким способом можно подготовить сразу несколько пластин и
при хранении их в сухом герметичном месте, сохраняют свои свойства несколько
месяцев.
Техника нанесения исследуемых растворов.
Как оказывается,
нанесение исследуемого вещества не такая сложная операция, но вместе с тем, она
очень влияет на получаемые результаты хроматографирования.
Часто, исследованию
подвергаются либо жидкие анализируемые вещества, либо растворы твердых веществ,
без какой либо предварительной пробаподготовки.
Поэтому необходимо
всегда помнить ряд моментов, серьезно влияющие на результаты разделения.
Наиболее важным
является концентрация наносимых веществ. В ТСХ принято наносить концентрации
растворов около 1%. Но с другой стороны чувствительность метода позволяет
определять вещества с гораздо меньшими концентрациями.
Если в исследуемом
веществе неизвестна общая концентрация компонентов, или известна концентрация
но такого типа вещества еще не хроматографировали, нужно определить какое
количество исследуемого раствора достаточно для качественного хромаграфирования.
Существуют несколько приемов, позволяющие это определить.
Для начала
нужно нанести несколько пятен хроматографируемых растворов, равные по размеру,
но с различным количеством (например 1, 2, 5 мкл) и после хроматографирования
изучить форму и размеры разделенных пятен.
Так при правильно
подобранной концентрации форма разделенных веществ такая же, как и форма
нанесенной на линии старта. Если разделенные пятна имеют большие размеры, чем
пятно на старте, то нанесенная концентрация слишком велика. Появление
"хвостов", неправильная форма разделенных пятен на пластинке тоже
может говорить о высокой концентрации, но может быть вызвана неправильно
подобранной хроматографической системой, либо химическим взаимодействием
разделяемых компонентов.
Подбором количества
нанесенного вещества и системы растворителей можно добиться полного разделения
на одной пластинке до десяти компонентов в исследуемых веществах.
Удобно наносить
образцы на специальном столике с трафаретами и подогревом. Нанесение пятен
проводят на "линии старта" 1-2 см от нижнего края пластинки. Это
необходимо для того, чтобы при опускании пластинки в систему не происходило
растворение в ней образцов, а все нанесенное вещество подверглось
хроматографированию.
Нанесение растворов
проводят либо микрошприцом, либо отградуированными капиллярами. Размер
наносимого пятна не должен превышать 4 мм. Это связано с тем, что при большем
размере пятна, происходит изменение формы под действием физических сил, да и
границы разделенных компонентов могут перекрываться.
Нанесение на
пластины исследуемых веществ не должны сопровождаться разрушением сорбента (что
довольно сильно влияет на качество разделения), поэтому капля должна наноситься
касанием иглы или капилляра о слой сорбента, а не надавливанием. На размер
образующегося пятна влияет не только количества наносимого раствора, но и от
полярности растворителя и его температуры кипения. Так при нанесении одного и
того же вещества в различных растворителях, образовавшееся пятно в котором в
качестве растворителя использовался метанол будет больше, чем пятно от раствора
хлороформа. с другой стороны при подогреве подложки испарение растворителей
будет интенсивнее и размер пятна также уменьшается.
Конечно, проще
использовать при нанесении для подсушивания пятен фен, но только в том случае,
когда есть полная уверенность, что наносимые вещества не будут окисляться под
действием горячего воздуха.
Расстояние между
наносимыми пятнами должно быть около 2 см.
Иногда при
хроматографировании на пластинках наблюдается краевой эффект, в результате чего
пятна располагаются не на одной линии а имеют вид подковы, либо по диагонали.
Для устранения этого эффекта каждое пятно можно "снабдить" своей
дорожкой, отделив нанесенный образец от других путем удаления линии сорбента.
Это лучше всего делать под линейку острым предметом (типа скальпеля) но
осторожно, чтобы не удалить слишком много сорбента.
После нанесения
исследуемых веществ на пластинку, необходимо добиться полного удаления
растворителей, так как даже небольшое содержание растворителя в исследуемом
веществе может повлиять на разделение и даже изменить состав хроматографической
системы.
Удаление
растворителей обычно проводят естественной сушкой пластин 5-10 мин, либо при
нагревании феном или в сушильном шкафу.
Хроматографирование
Тонкослойная хроматография имеет несколько способов, связанных, в основном, с видом движения растворителей.
·
·
·
·
Восходящая тонкослойная хроматография
Этот вид
хроматографии наиболее распространен и основан на том, что фронт
хроматографической системы поднимается по пластинке под действием капиллярных
сил, т.е. фронт хроматографической системы движется снизу-вверх. Для этого
метода используется наиболее простое оборудование, так как в качестве
хроматографической камеры можно использовать любую емкость с плоским дном и
плотно закрывающейся крышкой, в которую свободно помещается хроматографическая
пластинка.
Метод восходящей тонкослойной
хроматографии имеет ряд своих недостатков. Например, скорость поднятия фронта
по пластинке происходит неравномерно, т.е. в нижней части она самая высокая, а
по мере поднятия фронта уменьшается. Это связано с тем, что в верхней части
камеры насыщенность парами растворителя меньше, поэтому растворитель с
хроматографической пластинки испаряется интенсивнее, следовательно уменьшается
его концентрация и скорость движения замедляется. Для устранения этого
недостатка по стенкам хроматографической камеры прикрепляют полоски
фильтровальной бумаги, по которым поднимающаяся хроматографическая система
насыщает парами камеру по всему объему.
Некоторые
хроматографические камеры имеют на дне разделение на две ванночки. Это
усовершенствование позволяет не только уменьшить расход хроматографической
системы (для получения необходимой высоты хроматогратографической системы
требуется меньший объем) но и использовать дополнительную кювету для
растворителя, увеличивающего давления насыщенных паров в камере.
Недостатком также
можно считать необходимость следить за фронтом растворителя, так как возможно
"убегание" лини фронта растворителя до верхнего края. В таком случае
определить действительное значение Rf уже не представляется возможным.
Нисходящая тонкослойная хроматография
Этот метод
хроматографии основан на том, что фронт хроматографической системы опускается
по пластинке в основном под действием сил тяжести , т.е. фронт подвижной фазы
движется сверху вниз.
Для этого метода в
верхней части хроматографической камеры крепится кювета с хроматографической
системой из которой с помощью фитиля на хроматографическую пластинку поступает
растворитель, который стекает и происходит хроматографирование исследуемого
образца.
К недостаткам этого
метода можно отнести усложнение оборудования. Этот метод используется в
основном в бумажной хроматографии.
Горизонтальная тонкослойная хроматография
Этот метод
наиболее сложен в аппаратурном оформлении но наиболее удобен. Так, в
хроматографической камере пластинка размещается горизонтально и подача системы
происходит на один край пластинки с помощью фитиля. Фронт растворителя движется
в противоположную сторону.
Есть еще один прием,
позволяющий предельно упростить камеру. Для этого хроматографическую пластинку
на алюминиевой основе слегка изгибают и помещают в камеру. В данном случае система
будет поступать с двух сторон одновременно. Для этой цели подходят только
пластины с алюминиевой подложкой, так как пластиковая и стеклянная основа
"несгибаема", т.е. не сохраняет форму.
К достоинствам
этого метода можно отнести то, что в горизонтальной кювете насыщение
парами системы происходит гораздо быстрее, скорость движения фронта постоянная.
А при хроматографировании с двух сторон, фронт не "убегает"
Радиальная тонкослойная хроматография.
Радиальная тонкослойная хроматография заключается в том, что в центр пластинки наносится исследуемое вещество и туда же подается система, которая движется от центра к краю пластинки.
Сушка пластин.
После процесса
разделения исследуемых веществ, пластинки сушат. Это тоже немаловажный процесс,
так как при наличии на пластинке даже следов растворителя, возможно получить
неправильные результаты хроматографирования.
Если
хроматографическая система имела в своем составе только легкокипящие
компоненты, то достаточно естественной сушки в течении 3-5 минут. Если же в
состав системы входят высококипящие жидкости (спирты, вода, органические
кислоты и т.д.), сушку пластин нужно проводить не менее 10 мин или помещать
пластинку в сушильный шкаф.
Идентификация разделенных веществ.
Высушенная
пластинка является хроматограммой исследуемых веществ. Если вещества являются
окрашенными, то идентификация начинается с определения цвета разделенных
веществ.
Но в большинстве
случаев разделяемые вещества бесцветны и простое визуальное сравнение
невозможно.
Для тонкослойной
хроматографии существует несколько видов качественного анализа (идентификации)
разделенных веществ:
·
·
·
·
Рассмотрим подробнее каждый вид качественного анализа в тонкослойной хроматографии.
Физические методы
Визуальные
методы используются в основном, для определения местоположения пятен
разделенных веществ на хроматографической пластинке. Для этого пластинку
рассматривают как в видимом свете, так и используя ультрафиолетовый свет (в
основном свет с длиной волны 366 и 254 нм)
Это первый этап
идентификации, на котором определяется качество подобранных условий и
полученных результатов хроматографирования.
Так, определив
качество хроматографирования (отсутствие "хвостов" разделяемых
веществ или перекрытие их пятен, правильную форму и размеры, отсутствие слияния
хроматографических дорожек и т.д.) и признании пригодным проведенного
разделения для дальнейшего исследования, определяют Rf выявленных пятен.
Значение Rf.
Одним из
основных показателей в ТСХ является показатель Rf. Этот параметр является
аналогией времени удерживания и зависит как от свойств разделяемых веществ,
состава подвижной фазы и сорбента, так и от физических параметров.
Определение
значения Rf проводят как отношение расстояния прошедшего веществом к
расстоянию, прошедшего фронтом растворителя
Rf = L/L0
Значение Rf -
величина безразмерная и имеет значение от 0 до 1. Однако в литературе нередко
встречается такие показатели как hRf, Rf×100, которые являются тем же Rf,
но умноженными на 100, для того, чтобы не оперировать десятичными значениями.
На значение Rf не
влияет расстояние пройденное фронтом растворителя, однако во многих методиках
описывается прохождение фронта на расстояние 10 см. Это используется только для
облечения расчетов Rf.
На практике, в
начале определяют расстояние прошедшее фронтом растворителя: от линии старта (а
не от края пластинки) до места, где находился фронт в момент окончания
хроматографирования. Затем определяют расстояние от линии старта до пятна
разделенного вещества. Во тут и оказывает влияние размер пятна! Ведь если пятно
имеет круглую форму и небольшой размер, то полученное Rf имеет четкое значение.
А если полученное пятно имеет большой размер или неправильную форму, то при
определении Rf такого пятна, ошибка может достигнуть 0,1!
В случае
распределительной хроматографии коэффициент распределения вещества и его Rf
связано соотношением:

где Sп и Sн -площади поперечных
сечений подвижной и неподвижной фазы.
Как мы видим,
Коэффициент распределения, при постоянном отношении Sп/Sн есть величина
пропорционально зависящая от Rf , и может быть определена через него.
Цветные реакции.
Цветные реакции
в тонкослойной хроматографии используются чрезвычайно широко. Они служат не
только для определения местоположения разделенных компонентов (обработка серной
кислотой, парами йода), но и определения как класса веществ, так и
идентификации (при наличии индивидуальных реакций).
Мы не будем здесь
рассматривать это огромное разнообразие цветных качественных реакций, скажем
лишь, что при совпадении всех качественных реакций и совпадении полученных
значений Rf вещества в трех различных системах с литературными данными,
вещество идентифицировано. Хотя, на мой взгляд, необходимо дополнительное
подтверждение исследованием другим физико-химическим методом.
Сравнение со свидетелем.
При проведении
исследований веществ с предполагаемым составом, применяют метод
хроматографирования со свидетелем - известным веществом. Этот метод
используется кода трудно выдержать условия хроматографирования, нет
литературных данных Rf для данной системы или адсорбента, использование
градиентного метода и т.д. Да и при проведении цветных реакций можно сравнить
не только цвета, но и оттенки исследуемых веществ и свидетелей, что также
немаловажно.
С другой стороны
этот метод требует дополнительных расходов на свидетели.
Физико-химические методы идентификации.
Прелесть
тонкослойной хроматографии состоит в том, что после хроматографирования каждое
разделенное вещество можно в дальнейшем исследовать другими методами гораздо
проще. И дело тут не в том, что другие методы хроматографирования не могут
этого. Дело тут в сложности выделения и материальных затратах на специальные
приспособления, у которых только одна задача - выделить вещество.
В тонкослойной
хроматографии есть только одна трудность - снять слой сорбента и вымыть из него
вещество. В дальнейшем можно его исследовать с использованием ИК и
УФ-спектрометрии, рентгено-структурными методами, ЯМР и т.д.
Поэтому, используя
тонкослойную хроматографию для разделения смесей, можно не только исследовать
каждый компонент различными методами, но и наработать небольшое количество, в
том числе и для свидетелей.
Методы количественного анализа
Количественный анализ в тонкослойной хроматографии имеет несколько видов, характеризующий каждый этап развития метода. И хотя некоторые методы можно применять только как полуколичественные, они до сих пор применяются на практике.
Метод
визуального сравнения. Как говорилось выше, интенсивность окраски пятна и
его размер от количества хроматографируемого вещества. Поэтому визуальное
количественное определение построено на нескольких приемах.
Метод
разбавления. Этот метод заключается в том, что для каждого вещества
определяют предельную концентрацию, при которой вещество не может быть
определено хроматографическим методом. При хроматографировании исследуемого
вещества поводят разбавление до тех пор, пока оно перестает проявляться на
пластинке.
Содержание вещества
С, определенное таким методом находят по формуле:
C=an
где n-разбавление, а-концентрация
вещества, при котором оно не проявляется при хроматографировании.
Метод
определения площади пятна. Если наносить одинаковые объемы исследуемых
веществ и свидетелей, то получившиеся после хроматографирования площади пятен
пропорциональна логарифму концентрации вещества. S=
alnc + b
где а и b - эмпирические коэффициенты,
определяемые экспериментальным путем.
Если пятно
разделенного вещества имеет резкие границы, то площадь пятна можно определить
весовым методом (вырезать пятно и взвесить), замеряется планиметром. Этот метод
дает ошибку до 10-15%.
Однако он имеет ряд
существенных недостатков. Первый и самый существенный в том, что таким образом
можно определять концентрацию окрашенных веществ или имеющих флуоресценцию в УФ
области (254, 366 нм). Этот недостаток можно устранить добавлением в
сорбент различных люминофоров, то при этом увеличивается погрешность
определения.
Обработка пластин
проявляющими веществами (реактивами) также может быть использована (например
использование фильтровальной бумаги пропитанной проявляющим реагентом с
последующим контактом с хроматографической пластинкой и дальнейшим определением
на ней площади проявленного вещества), но погрешность определения также высока.
Необходимость более
достоверного результата количественного определения привела к использованию
инструментальных методов.
Метод
элюирования. Этот метод заключается в том, что разделенное вещество смывают
с сорбента растворителем и определяют его концентрацию уже другими методами -
фотометрическими, полярографическими и т.д. Это достаточно точный метод, но
только при условии количественного выделения разделенного вещества. Из-за
высокой трудоемкости метод используется достаточно редко и неприемлем при
большом количестве исследуемых образцов.
Фотографический
метод определения заключается в фотографировании пластинок с разделенным
веществом и дальнейшим определением степени почернения, с использованием
десинтометров.
Радиографический
метод аналогичен фотометрическому, только с той разницей, что определяется
почернение пластинки, вызванное излучением разделенного вещества. Этот метод
используется только при определении веществ с меченными атомами.
Фотодесинтометрический
метод может быть использован без выделения вещества с пластинки и основан
на определении не только площади пятна, но и его интенсивности.
Это наиболее точный
метод определения концентрации веществ, так как позволяет при использовании
калибровочных графиков, проводить достаточно точные количественные определения
всех разделенных веществ (до 2-10%) непосредственно на пластинке за короткий
промежуток времени.
Неудивительно, что
при развитии тонкослойной хроматографии, применение десинтометров
увеличивается, чувствительность и, следовательно, точность определения
концентрации разделенных веществ повышается и приближается к точности
высокоэффективной жидкостной хроматографии.
Рис. 1. Типичная камера для проявления хроматографической пластинки с тонким слоем

- крышка
- стеклянная камера
- пластинка ТСХ
- сорбент
- место нанесения пробы
- растворитель
Типичная ТСХ хроматограмма метиловых эфиров жирных кислот.


На хроматограмме FAME = fatty acids methyl esters = метиловые эфиры жирных кислот. Start = точка нанесения разделяемых смесей.
Хроматограмма выполнена на пластинке Sorbfil. Система - бензол. Проявление - обугливание после опрыскивания серной кислотой.
Точка 1 - метиловые эфиры жирных кислот. Точка 2 - продукты метилирования общих липидов.
Стрелкой показано направление движения фронта растворителя (системы). Фронт растворителя при хроматографировании двигался до верхнего края пластинки.
Применение метода ТСХ в фармации
Большое значение хроматографических методов для фармации связано с тем, что при производстве лекарств во многих случаях требуется предварительное выделение природных или синтетических продуктов в чистом виде. Проведение анализов также часто основано на разделении смесей на компоненты. Рассмотрим два примера применения метода ТСХ, доказывающих его значимость в анализе и производстве лекарственных веществ.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ТРИТЕРПЕНОВЫХ САПОНИНОВ МЕТОДОМ ВЭТСХ С ИСПОЛЬЗОВАНИЕМ СКАНИРУЮЩЕЙ ДЕНСИТОМЕТРИИ
Тритерпеновые сапонины (гликозиды) являются действующимн веществами многих лекарственных препаратов.
Большая часть применяемых в настоящее время методик количественного определения тритерпеновых сапонинов основана на кислотном гидролизе последних с дальнейшим определением агликона чаще всего титрометрическими, реже — спектральными методами анализа.
Подобные методики, основанные на разрушении молекул сапонинов, имеют ряд недостатков. Они длительны, не позволяют количественно оценить соотношение индивидуальных сапонинов в суммарных сапонинсодержащих препаратах.
В большинстве случаев авторы ограничиваются, как правило, качественной оценкой, используя метод ТСХ, наиболее доступный и простой хроматографическнй метод анализа. Применение ТСХ для определения количественного содержания компонентов сдерживается отсутствием сканирующих денситометров.
В настоящей работе приведены результаты количественного ТСХ-определения некоторых тритерпеновых сапонинов, производных олеаноловой кислоты, в фармпрепаратах и извлечениях из растительного сырья.
В качестве объектов исследования нами были выбраны тритерпеновые сапонины аралии маньчжурской (аралозиды). качественное определение которых в различных объектах освещено в работах, а также тритерпеновые сапонины сахарной свеклы — вещества с предварительно установленной фармакологической активностью. И те, и другие являются производными олеаноловой кислоты с небольшим (не более четырех) количеством сахарных остатков, что предполагает их сходное поведение в тонком слое сорбента
В качестве стандартов использовали сумму аралозидов, выделенных из таблеток "Сапарал" и сумму сапонинов сахарной свеклы, выделенных из свежеубранных корневищ. Для нанесения на пластину готовили водно-спиртовые (80 % по этанолу) растворы сапонинов с содержанием последних 0,4 — 2,0 мг/мл. Хроматографирование проводили с использованием пластин для ТСХ "Силуфол" (Чехия) 15 х 15 см, "Армсорб" для ВЭТСХ (Армения) 6 х 10 см и "Сорбфил" (Россия) 10 х 10см. Высота подъема фронта, достаточная для полного разделения, составляла 10,6 и 6 см, соответственно. Пробы наносили при помощи мнкрошприца МШ-10 (Россия) на пластину, подогретую до 40 "С. Оптимальный объем наносимой пробы — 3-5 мкл. Нанесение проводили в несколько приемов так, чтобы диаметр стартового пятна не превышал 2 мм.
Хроматографирование осуществляли при
температуре 20 - 25 °С. По окончании элюирования пластины подсушивали на воздухе
и обрабатывали детектирующим реагентом при помощи лабораторного стеклянного
пульверизатора. Сканирование зон проводили с использованием сканирующего
денситометра “Shimadzu CS-9000" (Япония). Сравнивали качество зон, получаемое
при хроматографировании в трех, наиболее часто рекомендуемых элюирующих
системах:
В качестве детектирующих реактивов использовали 25 % спиртовый раствор фосфорновольфрамовой кислоты (малиновые пятна сапонинов на белом фоне). наиболее часто применяемый для количественных ТСХ-определений подобных соединений и 10 % спиртовый раствор фосфорномолибденовой кислоты, рекомендуемый для проявления зон тритерпеноидов [13] (зоны сапонинов темно-синие на желтом фоне). Обработка пластин парами аммиака в последнем случае позволяет обесцветить фон и повысить контрастность пятен.
В результате проведенных исследований были выбраны оптимальные для денситометрического определения условия проведения хроматографического процесса. Лучшими из трех типов пластин были признаны "Армсорб" для ВЭТСХ. Высокой эффективности процесса способствует тонкий (II0 мкм) и однородный по фракционному составу (5—10 мкм) слой силикагеля, обеспечивающий хорошее разделение и минимальное размывание зон уже при подъеме фронта растворителя на 6 см. Почти не уступают им по разделительной способности пластины "Сорбфил", но время элюирования на них почти вдвое больше. Пластины "Силуфол" при достаточно высокой скорости элюирования позволяют разделить компоненты при большем хроматографичесюм пути, что приводит к некоторому размыванию зон, однако их использование также возможно.
Элюирование может быть проведено достаточно качественно в любой из первых трех элюирующих систем. I дает выигрыш во времени, IV позволяет получить лучшее разделение сапонинов сахарной свеклы, чем первые три.
Оба детектирующих реагента дают достаточно стабильное окрашивание зон при проведении сканирования в течение 1 - 2 ч с момента проявления. По истечении этого срока зоны сапонинов на пластинах, обработанных фосфорнонольфрамовой кислотой, изменяют окраску от малиновой до фиолетовой, что может привести к искажению результатов количественного анализа при сканировании. Обработка фосфорномолибденовой кислотой в этом случае более предпочтительна. При хранении в защищенном от света месте пластины с зонами, проявленными этим реактивом, дали вполне воспроизводимые результаты по истечении нескольких месяцев с момента проявления.
Предел обнаружения сапонинов составил 5 мкг в пробе при проявлении фосфорновольфрамовой кислотой и 0,5 мкг в пробе при проявлении фосфорномо-либденовой кислотой. Обработка парами аммиака позволила снизить предел обнаружения сапонинов в последнем случае до 0,2 мкг в пробе.
Количественное определение сапонинов методом ТСХ с использованием сканирующей денситометрии проводили на пластинах "Армсорб" (скорость хроматографирования в этом случае в 2 раза выше) или "Сорбфил", во II и III элюирующей системе (как содержащих менее токсичные компоненты). Детектирование зон осуществляли 10 % раствором фосфорномолибденовой кислоты. Объем наносимой пробы не более 5 мкл, высота подъема фронта элюента — 6 см, время элюирования 30 - 60 мин. Длина волны при сканировании λ = 675 нм. После обработки пластин сапонины аралии и сахарной свеклы проявляются в виде трех зон разной интенсивности.
Общий вид денситограмм, полученных при сканировании, представлен на рис. 1.
Сравнение хроматограмм сапонинов, выделенных из таблеток "Сапарал" (рис. 1, а) и "Настойки аралии" (рис. 1,6) позволяет отметить различное соотношение 44
аралозидов А, В и С, входящих в состав этих лекарственных форм. Подобное непостоянство соотношения индивидуальных сапонинов в сырье в зависимости oт условий произрастания растения отмечалось и ранее. Соотношение сапонинов в готовых лекарственных формах легко оценить при помощи полученных денситограмм. Поскольку на хроматограмме обнаруживается 3 зоны, соответствующие сапонинам, а на денситограмме, соответственно, три пика, при построении градуировочной зависимости площади всех пиков суммировали. Ошибка в этом случае была ниже, чем при проведении расчетов по параметрам пика одного из компонентов, учитывая непостоянство их соотношения (рис. 2).

Рис. I. Денситограммы, полученные при сканировании ТСХ-пластин: а — сапонины аралии, выделенные из таблеток “Сапарал”; 6 — сапонины настойки аралии; в — сапонины сахарной свеклы. Суммарное содержание сапонинов в пробе — 5 мкг. А, В, С— пики сапонинов; 0 — линия старта; f— линия фронта.
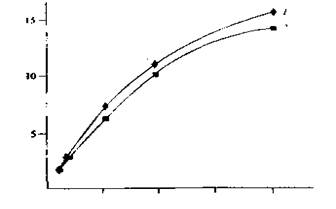
Рис. 2. Градуировочная зависимость суммы площадей пикон сапонинов на хроматограмме от их содержания в пробе. / — сапонины аралии; 2 — сапонины сахарной свеклы. По оси абцисс — солержание сапонинов в пробе (мкг), по оси ординат —сумма площадей пиков (см2).
Градуировочную зависимость суммы площадей пиков на денситограмме от содержания вещества в пробе получали хроматографированием серии стандартных растворов с известным содержанием сапонинов. Исходный раствор готовили растворением в 80 % этаноле точной навески сапонинов, высушенной до постоянной массы. Серию рабочих растворов готовили последовательным разбавлением исходного 80% этанолом. Содержание сапонинов в них составляло 0,04 - 2,0 мг/мл (0,2 - 10 мкг в пробе при объеме пробы 5 мкл). Этот концентрационный диапазон можно считать оптимальным при сканировании. Минимальное содержание сапонинов, определяемое этим методом, составляет 0,2 мкг/пробе. Относительное стандартное отклонение в этом случае не превышает 0,03.
Полученные градуировочные зависимости имеют нелинейный характер, что полностью согласуется с теорией Кубелки - Мунка, учитывающей поглощение и рассеивание света сорбентом. В узком диапазоне малых концентраций зависимости можно рассматривать как линейные (0,2 - 2,0 мкг/пробе). Нелинейная часть кривых может быть линеаризована переводом количества вещества в пробе и площади пика в обратные величины и приобретает вид, представленный на рис. 3.

Рис. 3. Зависимость обратной величины суммы площадей пиков сапонинов на хроматограмме (1/S • 10-1) от их обратной величины содержания в пробе (1/m - 10-1). 1 —сапонины аралии; 2 — сапонины сахарной свеклы.
При помощи полученной градуировочной зависимости определяли содержание сапонинов в настойке аралии. 5мл настойки разбавляли 70% этанолом в мерной колбе емкостью 25 мл. 5 мкл полученного раствора наносили на стартовую линию пластаны ''Армсорб". В соседнюю точку наносили 5 мкл стандартного раствора аралозидов с концентрацией I мг/мл (5 мкг в пробе). Пластинки обрабатывали, как описано выше.
Отличие полученных результатов от результатов определения по ФС 42-1647-93 (5,3 мг/мл) составило 6 — 7 % в сторону завышения, что может быть объяснено потерями сапонинов при проведении многостадийной предподготовки пробы по ФС (таблица).
Описанным выше способом были проведены определения сапонинов в таблетках "Сапарал" и в растительном сырье (корнях аралии маньчжурской и корневищах сахарной свеклы) с предварительной исчерпывающей экстракцией сапонинов из таблеток из сырья — 80 % горячим этанолом. Отклонения от результатов определения по ФС 42-1755 - 81 для таблеток (0,040 г) находятся в тех же пределах, что и для настойки (таблица).
Таким образом показана возможность экспрессного количественного определения некоторых тритерпеновых сапонинов, производных олеаноловой кислоты в фармпрепаратах и растительном сырье методом ВЭТСХ с последующей количественной оценкой полученных зон с использованием сканирующей денситометрии.
Результаты определения достаточно хорошо коррелируют с результатами определения по ФС. Методика позволяет сочетать определение подлинности препаратов методом ТСХ (по ФС) с последующим сканированием зон компонентов на пластинах и их количественной оценкой. Хроматограммы, полученные при сканировании, позволяют определить также соотношение индивидуальных сапонинов в анализируемых объектах.
Результаты количеетвевного определения аралозндов в на-CTofik-c аралии (I) и таблетках "Сапарал" (2) методом ТГХ с использованием сканирующей дснсптоиетрнн /' = 0,95, и - 5, /=2,78,/=4
|
Метрологические характеристики |
1 |
2 |
|
|
5.66 |
0.043 |
|
S |
0.23 |
0.002 |
|
S |
0.1!) |
O.OOS4 |
|
ΔX |
0,64 |
0,0056 |
|
Δ<Х> |
0.28 |
0.0025 |
|
ε |
11.30 |
0.1302 |
|
<ε> |
4,95 |
0,0581 |
ИЗУЧЕНИЕ ЛИПИДНОГО И ФЛАВОНОИДНОГО СОСТАВА ОБРАЗЦОВ НЕКОТОРЫХ ВИДОВ РОДА ЧИНА (Lathyrus.)
Из многих представителей семейства Бобовые, такие как люцерна, люпин клевер, вика были выделены флавоноиды, обладающие широким спектром действия: противовоспалительным, ранозаживляющим, со-судоукрепляющим и т.д. Из красного клевера были выделены изофлавоны: биоханин А — 0,8 % и формо-нонетин — 0,78 %, обладающие эстрогенной активностью .
Нами изучался флавоноидный состав в отдельных видах рода чина: ч.посевная (I), члуговая (II), ч.весенняя (III), ч.лесная (IV).
С целью возможного использования липидного комплекса в пищевых добавках и лекарственных препаратах нами также изучался полный фракционный состав липидов в траве и семенах чины.
Материалы и методы
Выделение липидной фракции из сухого сырья проводили по методу Блая и Дайера.
К навеске (0,2 г) сухого растительного сырья добавляли 1,6 мл дистиллированной воды и выдерживали в течение суток на холоду. Затем добавляли 6 мл смеси хлороформ — метанол (1 :2) и оставляли на 3 суток, после чего центрифугировали при 8 тыс. об/мин — 15 мин. К прозрачному супернатанту добавляли 2 мл воды и 2 мл хлороформа. Образовавшуюся 2-х фазную систему разделяли в делительной воронке. Хлороформный слой дважды промывался метанолом и упаривался досуха на роторном испарителе. Остаток сушили в вакуум-эксикаторе, затем разбавляли хлороформом до концентрации 10 мг/мл и раствор хранили в стабилизированном хлороформе при + 4°С.
Качественный анализ липидной фракции проводили с использованием метода ТСХ на пластинах Кизельгель 60 (254) в следующих системах растворителей:
А. Для нейтральных липидов: 1) Гексан — бензол (9:1) [4]; 2) Гексан — эфир — уксусная кислота (90:10:1) [5].
Б. Для полярных липидов (фосфолипидов): 1) хлороформ — ацетон — метанол — уксусная кислота — вода (6:8:2:2:1), кислый; 2) хлороформ — мета-
нол — 26% аммиак (65:25:5), основной; 3) хлороформ — метанол — вода (65:25:4), нейтральный.
При определении качественного состава фосфолипидов их идентификация проводилась с использованием различных проявителей (пары йода, нингидрин, реактив Драгендорфа, серная кислота) и с помощью Rf стандартов.
Вышеперечисленный набор систем и реактивов позволил исчерпывающе провести анализ липидных фракций, выделенных из образцов чины.
Для изучения флавоноидного состава с учетом фаз вегетации были выбраны следующие образцы: I (фаза цветения); IV (фаза цветения); III (сочевичник) фаза бутонизации; II (фаза цветения); II (фаза плодоношения); II (фаза вегетации до цветения).
Выделение флавоноидов из сухого сырья проводилось по методике, обеспечивающей их исчерпывающую экстракцию.
С этой целью, 1 г измельченной травы помещали в колбу с обратным холодильником, заливали 20 мл 70 % этанолом и кипятили в течение 20 мин на водяной бане. Экстракт охлаждали, фильтровали через стеклянный фильтр Шотта и упаривали досуха на роторном испарителе. Остаток растворяли в спирте этиловом до конечной концентрации вещества 10 мг/мл. Определение суммарного содержания флавоноидов проводилось с использованием рутина в качестве стандарта. Результаты этого исследования приведены в табл. 3.
Определение качественного состава флавоноидов проводилось методом ТСХ на пластинках Кизельгель 60(254) фирмы Мерк, в системе растворителей н-бутанол — уксусная кислота — вода (6:1:2). Обнаружитель — серная кислота при УФ (254 нм) — пятна флавоноидов сиреневого цвета на зеленом фоне.
Таблица 1
Суммарное содержание флавоноидов в сырье (трава) различных видов чины (в %, в пересчете на абсолютно сухую массу)
|
№ пп |
Вид чины |
Содержание суммы флавоноидов (%) |
|
1 |
I, фаза цветения |
4,51 |
|
2 |
IV, фаза цветения |
1,23 |
|
3 |
III, (сочевичник), фаза бутонизации |
0,28 |
|
4 |
II, фаза цветения |
3,56 |
|
5 |
II, фаза плодоношения |
1,50 |
|
6 |
II, фаза вегетации. До цветения |
1,25 |

Рис. 1. ТСХ флавоноидного состава отдельных видов рода Чина. С — сумма свидетелей флавоноидов: ононин — Rf 0,28; рутин — R,0,48; лютеолин-глюкозид — Rf 0,58; формононетин — Rf 0,64; кверцетин — Rf0,79: лютеолин — Rf 0,82; биоханин А — Rf 0,85; апигенин — Rf 0,92.

Рис. 2. ТСХ флавоноидов чины луговой по разным фазам вегетации. IIа — фаза цветения; IIб — фаза плодоношения: IIв — фаза вегетации до цветения. С — сумма свидетелей флавоноидов: ононин — Rf f0,28; рутин — Rf 0,48; лютеолин-глюкозид — Rf 0,58; формононетин — Rf 0,64; кверцетин — Rf 0,79; лютеолин — R( 0,82; биоханин А •— Rf 0,85; апигенин — Rf 0,92.
При исследовании флавоноидного состава II в разных фазах вегетации отмечено, что кроме рутина и кверцетина, в экстракте присутствуют в заметном количестве ононин и формононетин. Остальные флавоноиды найдены в следовых количествах.
Таким образом показано, что в различных видах чины, в различные фазы вегетации содержатся как гликозиды, так и агликоны — ононин, рутин, лютеолин-глюкозид и их агликоны: формононетин, кверцетин и лютеолин, причем состав их меняется как в зависимости от вида растения, так и у одного растения (чина луговая) в зависимости от фазы вегетации.
Таблица 2
Количественное содержание основных флавоноидов в отдельных представителях рода чины (в %, в пересчете на абсолютно сухую массу)
|
Содержание флаваноидов (%) |
||||||
|
Наименование флавоноида |
фаза цветения |
фаза бутонизации |
фаза плодоношения |
фаза вегетации |
||
|
I |
IV |
II |
III |
II |
II |
|
|
Ононин |
25 |
10 |
14 |
8 |
15 |
22 |
|
Рутин |
31 |
15 |
20 |
8 |
10 |
12 |
|
Лютеолин- глюкозид |
9 |
10 |
17 |
10 |
17 |
17 |
|
Формононетин |
5 |
8 |
18 |
10 |
18 |
13 |
|
Кверцетин |
5 |
12 |
8 |
20 |
8 |
8 |
|
Лютеолин |
1,5 |
12 |
1,5 |
22 |
2 |
1,5 |
У II в вегетативном периоде найден как ононин, так и формононетин. В период цветения и плодоношения количество ононина заметно снижается, а количество формононетина — увеличивается.
Количественное содержание основных флавоноидов в исследуемых образцах определялось с помощью количественной ТСХ в тех же условиях. Результаты этого исследования приведены в табл. 2.
Как следует из данных табл. 2, различные виды чины являются богатым источником блофлавоноидов, благодаря которым эти растения проявляют один из видов биологической активности.
Заключение:
Одна из важных задач современной химии – надежный и точный анализ органических веществ, часто близких по строению и свойствам. Без этого невозможно проведение химических, биохимических и медицинских исследований, на этом в значительной степени базируются экологические методы анализа окружающей среды, криминалистическая экспертиза, а также химическая, нефтяная, газовая, пищевая, медицинская отрасли промышленности и многие другие отрасли народного хозяйства. Здесь приведена только незначительная часть методов и приемов тонкослойной хроматографии. Но как видно из этого малого, тонкослойная хроматография обладает значительными и серьезными возможностями, в сочетании с удобством и простотой.
Литература:
- Березкин В.Г., Бочков А.С. Количественная тонкослойная хроматография. М.: Наука, 1994, 183 с.;.
- Алесковский В.Б., Бардин В.В., Булатов М.И. Физико-химические методы анализа. Практическое руководство.- Л.: Химия, 1988. - 376с.
- Зайчикова С. Г., Самылина И. А. Химико-фармацевтический журнал. Том 35, № 5, 2001, с. 36-38
- Брежнева Т. А., Селеменев В. Ф. и др. Химико-фармацевтический журнал. Том 34, № 9, 1999, с. 43-45