Клонирование
| Загрузить архив: | |
| Файл: ref-27246.zip (451kb [zip], Скачиваний: 120) скачать |
Министерство общегои профессионального образования Свердловской области
МОУ СОШ №24 Кировского района



Исполнитель:
ученица11класса
Ширинова А.
Руководитель:
Порубенко Н.В
Екатеринбург
2018
Содержание
I. Введение …………………………………...…………………..……2
II. Основная часть ……………………..…………………………….3
1.Теория клонирования ………………………………………………………….4
2. Виды клонирования ……...………………………………………………...….6
3.Клонирование растений………………...………………………………………9 4.Клонирование животных……………………………………………………...10
5.Тканевоеклонирование ……………………………………………………...28 6.Задачи, стоящие перед клонированием ……………………………………...30
III. Заключение………………………………………………………33
IV. Списоклитературы...…………………...……………………...37
V. Приложение……………………………………………………….38
1.Хронология клонирования………………………………………………...….38
2.Определения…………………………………………………………………...41
3.Схемыклонирования…………………………………………………………42
Введение
В последние десятилетия прошлого века происходило бурное развитие одной из интереснейших ветвей биологической науки - молекулярной генетики. Уже в начале 1970-х годов возникло новое направление генетики - генная инженерия. На основе ее методологии начали разрабатываться различного рода биотехнологии, создаваться генетически измененные организмы. Появилась возможность генной терапии некоторых заболеваний человека. К настоящему времени учеными сделано множество открытий в области клонировании животных из соматических клеток, которые успешно применяются на практике.
Идея клонирования Homo sapiens ставит перед человечеством такие проблемы, с какими оно прежде не сталкивалось. Так развивается наука, что каждый ее новый шаг несет с собой не только новые, неведомые ранее возможности, но и новые опасности.
Клонирование человека сейчас уже очень близко к реальности благодаря историческому научному прорыву д-ра Яна Вильмута и его коллег из Великобритании. Эта возможность потенциально дает всем нам невероятные преимущества. К сожалению, на обсуждение этой темы с самого начала оказывали влияние сенсационные, но вводящие в заблуждение сообщения СМИ, и общая негативная эмоциональная реакция, порожденная ошибочной научной фантастикой. Отрицательное отношение к клонированию людей - больше следствие захватывающей дух новизны идеи, чем каких-либо реальных нежелательных последствий. При разумном регулировании преимущества клонирования людей существенно перевесили бы недостатки. Если введенная в заблуждение общественность наложит полный запрет на клонирование человека, это оказалось бы печальным эпизодом в человеческой истории.
1.Теория клонирования
Термин клонпроисходитот греческогослова«klon», чтоозначает веточка, побег, отпрыск. Клонированию можнодаватьмного определений, вотнекоторыесамые распространенныеизних, клонирование – популяцияклетокили организмовпроизошедшихот общегопредкапутём беспологоразмножения, причёмпотомок приэтомгенетически идентиченсвоемупредку. Клонирование – образование идентичных потомков (клонов) путём бесполого размножения. Результатом клонирования является популяция клеток или организмов с одинаковым набором генов (генотип).
Воспроизводствоорганизмов полностьюповторяющихособь, возможнотолько втомслучае, если генетическаяинформацияматери будетбез каких-либоизменений переданадочерям. Нопри естественномполовомразмножении этомупрепятствуетмейоз. В ходеэтогонезрелая яйцеклетка, имеющаядвойной, илидиплоидныйнабор хромосом – носителей наследственнойинформации – делитьсядваждыи врезультатеобразуются четырегаплоидных, содинарным наборомхромосом, клетки. Трииз нихдегенерируют, ачетвёртая сбольшимзапасом питательныхвеществ, становитсяяйцеклеткой. Умногих животныхонав силугаплоидностине можетразвиватьсяв новыйорганизм. Дляэтого необходимооплодотворение. Организм, развившийсяизоплодотвореннойяйцеклетки, приобретаетпризнаки, которыеопределяются взаимодействиемматеринскойи отцовскойнаследственности. Следовательно, приполовомразмножении матьнеможет бытьповторенав потомстве.
Как жевопрекиэтой строгойзакономерностизаставить клеткуразвиватьсятолько сматеринскимдиплоидным наборомхромосом? Теоретически решениеэтойтрудной биологическойпроблемы найдено.
Для процедуры клонирования (или копирования) используется молекула ДНК того живого существа, которое предполагается копировать. Молекула ДНК заимствуется из одного живого организма и вживляется внутрь яйцеклетки другого живого существа того же вида. Тотчас же послеэтого процесса вживления применяется электрический шок, которые вызывает начало стремительного процесса деления яйцеклетки. Таким образом, внутри яйцеклетки формируется эмбрион, зародыш. Эмбрион, продолжающий делиться, помещают в матку любого животного того же вида и ждут, пока созревающее внутри живого существа животное не родится на свет.
Клонирование происходит в три основных этапа:
1. Из яйцеклетки самки полностью удаляется ДНК. Таким образом, клетка становится пустой оболочкой, которая не имеет генетической информации.
2. В эту пустую оболочку вводится предварительно реактивированная зрелая клетка (клетка-донор).
3. Оплодотворенная яйцеклетка пересаживается в матку самки (суррогатной матери). Плод, которого донор и клон генетически идентичны, как и однояйцовые близнецы. Близнецы тождественны генетически, однако, подрастая, часто оказываются совершенно разными личностями. Это отличие вызвано:
Донор и клон генетически идентичны, как и однояйцовые близнецы. Близнецы тождественны генетически, однако, подрастая, часто оказываются совершенно разными личностями. Это отличие вызвано:
а)уникальностью души, как следствие, характеров;
б) различием жизненного опыта.
Единственная разница между близнецом и клоном заключается в том, что близнецы — ровесники, а клон отделен от матрицы поколением или, если быть более точным, возрастом донорской клетки.
2.Виды клонирования
На сегодняшний день известно несколько видов
клонирования, среди которых наиболее близким к естественному размножению
является эмбриональное клонирование. В
ходе этого процесса создается дубликат плода, который сформирован в матке
матери естественным путем. Ученые научились делить зиготу на ранней стадии ее
развития на две и более частей. В результате такого разделения появляется клон
первоначальной зиготы, и обе зиготы впоследствии вырастают в близнецов,
рожденных путем эмбрионального клонирования. В природе сходные процессы нередко
происходят и без участия человека, когда появляются на свет однояйцовые
близнецы. Таким образом, путем эмбрионального клонирования можно получить клон
ребенка еще на эмбриональном этапе его развития.
Однако в настоящее время основное внимание исследователей
сосредоточено на клонировании путем
пересадки ядер. Между учеными существуют большие разногласия по поводу
того, являются ли полученные таким способом особи клоном в полном смысле этого
слова. Дело в том, что эукариотическая клетка, обладающая оформленным клеточным
ядром, содержит два различных генома. Геномом называется совокупность генов,
содержащихся в одинарном наборе хромосом данного организма. Один из них
находится в ядре (яДНК) и наследуется в соответствии с законами Менделя. Другой
располагается в митохондриях (мДНК) и передается через цитоплазму яйцеклетки.
Этот процесс называется цитоплазматической наследственностью.
При клонировании млекопитающих путем
пересадки ядер донорская соматическая клетка под воздействием электрического
тока целиком сливается с цитоплазмой безъядерной яйцеклетки. В результате
такого слияния в яйцеклетку переносится как яДНК, так и мДНК донорской клетки.
Таким образом, гибридная клетка содержит мДНК как из донорской, так и из реципиентной
цитоплазмы.
До недавнего времени для подтверждения
пересадки ядер и происхождения полученных особей изучалась только их яДНК. Лишь
недавно ученые начали детально изучать геном митохондрий и влияние цитоплазматической
наследственности.
В
зависимости от целей, поставленных перед исследователями, клонирование путем
пересадки ядер бывает репродуктивным и терапевтическим.
Репродуктивное клонирование – это искусственное воспроизведение в
лабораторных условиях генетически точной копии любого живого существа. Целью
репродуктивного клонирования является создание клона – генетической копии
живущего или даже давно умершего существа. Овечка Долли стала первым примером
подобного клонирования крупного животного. Весь этот процесс состоит из
нескольких стадий. Сначала у женской особи берется яйцеклетка, из которой
микроскопической пипеткой вытягивается ядро. Затем в безъядерную яйцеклетку
вводится любая клетка, содержащая ДНК клонируемого организма. Фактически, она
имитирует роль сперматозоида при оплодотворении яйцеклетки. С момента слияния
клетки с яйцеклеткой начинается процесс размножения клеток и рост эмбриона.
Репродуктивное клонирование имеет огромное научное и прикладное значение для
животноводства, но если речь идет о клонировании человека, то оно единодушно
осуждается общественностью и подавляющим большинством ученых.
Во многих странах, включая Россию, репродуктивное клонирование человека с целью получения детей-клонов запрещено законом. В Великобритании подобное клонирование человека карается тюремным заключением сроком до 10 лет. Терапевтическое клонирование отличается от репродуктивного клонирования тем, что по прошествии двух недель роста эмбриона процесс размножения клеток искусственно прерывается.
По
мнению большинства ученых, после 14-дневного срока в эмбриональных клетках
начинает развиваться центральная нервная система и конгломерат клеток (эмбрион,
бластоцист) уже следует считать живым существом.
Еще
одно отличие терапевтического
клонирования от репродуктивного заключается в изначальной цели этого
процесса. Целью терапевтического клонирования является получение не клонов
живых существ, а так называемых эмбриональных стволовых клеток (ЭСК). В ходе
исследований было установлено, что образующиеся в течение первых 14 дней ЭСК
способны в дальнейшем превращаться в специфические тканевые клетки отдельных
органов (сердца, почек, печени, поджелудочной железы и т.д.) и использоваться в
медицине для терапии многих заболеваний. Законодательство Великобритании
разрешает проводить терапевтическое клонирование и исследовать возможности
дальнейшего применения стволовых клеток в медицинских целях. В России многие
ученые, например, академик РАМН Н.П.Бочков, профессор Института молекулярной
генетики В.З.Тарантул, предпочитают не употреблять термин «терапевтическое
клонирование» и называют этот процесс «клеточным размножением».
Каковы
же перспективы терапевтического клонирования?
По мнению исследователей, получение в большом количестве ЭСК даст возможность медикам лечить диабет, болезнь Паркинсона, болезнь Альцгеймера, инфаркт миокарда, болезни почек, печени, заболевания костей, крови и многие другие болезни.
3.Клонирование растений
Клонирование,прежде всего,изначальноотносится квегетативномуразмножению. Клонированиерастений черенками, почкамииликлубнями известноужеболее 4тысячлет. Начиная с70-хгг. нашегостолетиядля клонированиярастенийстали широкоиспользоватьнебольшие группыидаже соматические (неполовые)клетки.
Деловтом, что урастенийв отличиеотживотных помереих роста, входеклеточной специализации – дифференцировки – клетки нетеряюттак называемыетотипотентныесвойства, то есть,нетеряют своейспособностиреализовывать всюгенетическуюинформацию, заложеннуюв ядре. Поэтомупрактическилюбая растительнаяклетка, сохранившеевпроцессе дифференцировкисвоёядро, может датьначалоновому оргазму. Этаособенностьрастительных клетоклежитв основемногихметодов генетикииселекции.
При вегетативномразмножениииприклонировании генынераспределяютсяпо потокам, каквслучае половогоразмножения, а сохраняются вполномсоставе втечениемногих поколений. Все организмы, входящие всоставопределённого клонаимеютодинаковый наборгенови фенотипическинеразличаются междусобой.
Клеткиживотных, дифференцируясь, лишаютсятотипотенстности, ив этом, одноизсущественных отличийотклеток растений. Какбудетпоказано нижеименноздесь главноепрепятствиедля клонированиявзрослыхпозвоночных животных.
4.Клонирование животных
Клонированиешелкопряда
В изобретениеклонированияживотных, несомненно,надоотдать должноерусскимучёным. Сто лет томуназад русский зоологмосковскогоуниверситета А.А.Тихомироввпервыеоткрыл, что яичкитутовогошелкопряда врезультатеразличных химическихифизических воздействийначинаютразвиваться безоплодотворения.
Однако эторазвитие, названноепартеногенезом, раноостанавливалось: партеногенетическиеэмбрионы погиблиещёдо вылупленияличинокиз яиц. Ноэтоуже былапрелюдияк клонированиюживотных.
Л.Л. Астауровв30-е гг.врезультате длительныхисследований, получившихмировуюизвестность, подобралтермическое воздействие, которое одновременноактивизировалонеоплодотворённое яйцо кразвитию и блокировало стадиюмейоза, то естьпревращениедиплоидного ядраяйцеклеткив гаплоидное. Развитиесядром, оставшимсядиплоидным, заканчивалосьвылуплением личинок, точноповторяющихгенотип матери, включаяипол. Так, в результатеамейотическогопартеногенеза были полученыпервыегенетические копии, идентичныематери.
Количествовылупившихся партеногенетическихгусеницнаходилось взависимостиот жизнеспособностиматери.
Поэтому у«чистых»породвылуплениегусениц непревышало1%, в товремякак узначительноболее жизнеспособныхмежрасовыхгибридов онодостигло40-50%. Несмотряна огромныйуспех, авторэтого методапережил горькое разочарование: партеногенетическое потомствохарактеризовалось пониженнойжизнеспособностью наэмбриональных ипостэмбриональных стадиях развития (гусеницы, куколки, бабочки). Гусеницы развивалисьнеравномерно, среди нихбыло многоуродливых, азавитые имикоконыразличались помассе.
Позже Астауровулучшилметод, применивгибридизацию междуселекционнымилиниями.
Так онсмогповысить жизнеспособностьуновых клоновдонормы, но довестидоэтого уровнядругиеколичественныепризнаки емунеудалось: напримермасса партеногенетическихкоконовне превышала82%от массынормальныхкоконов такогожегенотипа.
Позднееустановили причиныпартеногенетическойдепрессии исложнымиметодами, которыепозволили накапливать«геныпартеногенеза», вывелиновые высоко жизнестойкиеклонысамок, а позднееипартеногенетическихсамцов. Скрещиваятаких самцовсосвоими «матерями»илисклонными кпартеногенезусамками другихклонов, получилипотомство с ещёбольшей склонностьюкпартеногенезу. Отлучших вэтомотношении самокзакладывалиновые клоны.
В результатемноголетнегоотбора удалосьнакопить в генотипеселекционируемых клонов невиданно большое число генов, обуславливающих высокуюсклонностьк партеногенезу. Вылупление гусеницдостигло90%, а ихжизнеспособностьповысилась до95-100%, опередиввэтомотношении обычныепородыи гибриды. Вдальнейшем«скрестили» спомощьюпартеногенетическихсамцов двагенетически резкоотличающихся клонаразныхрас иотлучших гибридныхсамоквывели сверхжизнеспособныеклоны.
Наконец, научилиськлонировать самцовтутовогошелкопряда. Этостало возможнымпослетого, как удалосьполучитьсамцов, у которыхвсепарные геныбылиидентичными, илигомозиготными. Вначалетаких самцовклонировалиособым мужскимпартеногенезом (андрогенезом). Дляэтоговоздействием гамма-лучейивысокой температурылишалиядро яйцаспособностик оплодотворению. Ядро проникшегов такоеяйцосперматозоида, невстретив дееспособногоженского ядра, само, удваиваясь, приступало к развитию мужского зародыша, которыйестественноповторял генотипотца. Такимспособом ведутсямужскиеклоны вдесяткахпоколениях.
Позже одинизтаких клоновбылпреобразован вобо половуюлинию, также состоящихизгенетически идентичных(заисключением половыххромосом)теперь ужесамоки самцов. Посколькуположившийначало этойлинииполностью гомозиготныйотецвозник врезультатеразмножения, приравненногок самооплодотворению, тосамон илиниядвойников обоегополаимеют пониженнуюжизнеспособность. Скрещиваямеждусобой дветакиелинии, стали безтрудаполучать гибридныхивысоко жизнеспособныхдвойниковв неограниченномколичестве.
Итоги клонированияшелкопряда: полученныеклонысамок исамцовтутового шелкопрядадля практическогошелководстванепригодны, ноэто некрахвсех надежд. Целесообразно использоватьклоныне длянепосредственногоприменения вшелководческойпрактике, а наплемядля выдающегосяпопродуктивностипотомства. Примернаясхема использованияклоновв промышленномпроизводствевыглядит следующимобразом. Избольшого количествакоконоввыбирают те, изкоторыхразвиваются выдающиесяпопродуктивностисамки, и откаждойполучают партеногенетическоепотомство, длядальнейшейработы используютпартеногенетическихклоны, которыеповторяют высокуюпродуктивностьматери ипроявляютвысокую склонностькпартеногенезу.
За этим следует скрещивание с определённымиклонированнымисамцами, и из полученного гибридного поколения выбирают двапроизводства, только те клоны, которые дали прекрасное во всехотношениях потомство. Еговысокиекачества обусловленынетолько предшествующейселекцией, аещё итем, чтов процессеотбораособей навысокую склонность к партеногенезу в их генотипе образуетсякомплексгенов жизнеспособности, компенсирующей вредное влияниеискусственногоразмножения. Припереводе клоновнаполовое размножениеэтоткомплекс, оказавшисьнесбалансированным, сильноповышает гетерозис.
Первыеопыты наамфибиях
Возможностьклонирования эмбрионов позвоночныхвпервыебыла показанавконце 40-хначале50-х гг.вопытах наамфибиях, когдароссийский эмбриологГеоргийВикторович Лобашовразработалметод пересадки(трансплантации)ядер вяйцеклеткулягушки. В июне1948года онотправилв «Журналобщейбиологии» статью, написаннуюпоматериалам собственныхэкспериментов. ОднаконабедуЛобашовав августе1948года состояласьпечальноизвестная сессияВАСХНИЛ, утвердившаяпо волекоммунистическихвождей беспредельноегосподствов биологиималограмотногоагронома Т.Д. Лысенко, инаборстатьи Лобашова, принятойк печати, был рассыпан, потомучтоона доказывалаведущуюроль ядраисодержащихся внёмхромосом виндивидуальномразвитии организмов. Работу Лобашова забыли, а в
50-х гг.американскиеэмбриологи БригсиКинг выполнилисходныеопыты, и приоритетдосталсяим, как эточастослучалось висториироссийской науки.
Бригс иКингразработали микрохирургическийметодпересадки ядерэмбриональныхклеток спомощьютонкой стекляннойпипеткивлишённыеядра клетки (энуклеированныеклетки).
Ониустановили, чтоесли братьядраиз клетокзародышана раннейстадииего развития – бластуле (бластула – стадия вразвитиизародыша, представляющаясобой полныйшариз одногослояклеток), то примернов80% случаяхзародышиблагополучно развиваютсядальшеи превращаютсявнормального головастика. Еслижеразвитие зародышейпродвинулосьна следующуюстадию – гаструлу, толишь менеечемв 20%случаев оперированные клетки развивались нормально. Эти результатыпозжебыли подтвержденывдругих работах.
Большой вкладвэту областьвнёсанглийский биологГордон. Онпервый в опытахс южноафриканскойжабой Xenopus laevisв качестведонора ядер использовал не зародышевые клетки, а уже вполне специализировавшиеся клетки эпителия кишечника плавающегоголовастика. Ядраяйцеклеток-реципиентовон неудалялхирургическим путём, аразрушалультрафиолетовыми лучами. Вбольшинстве случаевреконструированныеяйцеклетки неразвивались, нопримерно десятаячастьизнихобразовывала эмбрионы, 5%изэтих эмбрионовдостигалистадии бластулы, 2,5% стадии головастикаитолько 1%развивалосьв половозрелые особи(схема)однако появлениенесколькихвзрослых особейвтаких условияхмоглобыть связанос тем, чтосреди клетокэпителиякишечника развивающегосяголовастикадовольно длительноприсутствуютпервичные половыеклетки, ядра,которых моглибытьиспользованы дляпересадки. Впоследующих работах, каксамогоавтора, так идругихисследователейне смоглиподтвердитьданные этихпервыхопытов.
Позже Гордон модифицировалэксперимент. Посколькубольшинство реконструированных яйцеклетоксядром клеткикишечногоэпителия погибаютдозавершения стадиигаструлы, онпопробовал извлечьизних ядранастадии бластулыиснова пересадитьихв новыеэнуклеированныеяйцеклетки, такая процедура называется«серийной пересадкой». Числозародышейс нормальнымразвитиемпосле этогоувеличилось,и ониразвивалисьдо болеепозднихстадий посравнениюс зародышами, полученнымив результате первичнойпересадкиядер.
Затем Гордонвместес Ласки(1970 год)стали культивировать(внеорганизма впитательнойсреде) клеткипочки, лёгкогои коживзрослыхживотных ииспользоватьуже этиклеткив качестведоноровядер. Примерно25% первичнореконструированныхяйцеклеток развивалисьдостадии бластулы. Присерийныхпересадках ониразвивалисьдо стадииголовастика.
Такимобразом, былопоказано, чтоклетки 3-хразныхтканей взрослогопозвоночногосодержит ядра, которыемогутобеспечить развитиепокрайней может достадии головастика.
В свою очередь Ди Берардино и Хофнериспользовали длятрансплантацииядра неделящихсяиполностью дифференцированныхклетоккрови – эритроцитовлягушки «RanaPipiens». Послесерийной пересадкитакихядер 10%реконструированныхяйцеклеток достигалистадииплавающего головастика. Однакодажес помощьюмногократныхсерийных пересадок (более100клеточных циклов)реконструированныеяйцеклетки дальшестадииголовастика неразвивались.
Таким образом,вомногих работахпоказано, чтов случаиамфибийдонорами ядермогутстать лишьзародыши на раннихстадияхразвития. Некоторыеавторы называют подобные экспериментыклонированиемамфибий, хотя правильнее ихназывать клонированием эмбрионовамфибий, так как в этом случаеразмножаютбесполым путёмневзрослых животных, аихзародышей.
Дифференцировкаклеток в ходе развитияпозвоночныхсопровождаетсяинактиваций неработающих генов, поэтому клетки теряюттотипотентность, дифференцировкастановится необратимой. Вконцеконцов, уоднихклеток происходитрепрессированиегенома, у другихвтой илиинойстепени деградируетДНК, авнекоторыхслучаях разрушается дажеядро. Однако наряду сдифференцируемымиклетками, культивируемыми «invitro» клеточные популяции содержат малодифференцируемыестволовые клетки, которыеимогут быть использованыкак донорыядердля клонированиямлекопитающих.
Опытыс амфибиямипоказали, чтоядра различныхклетокодного итого жеорганизма генетическиидентичныивпроцессе дифференцирвки постепенно теряют способность обеспечивать развитиереконструированных яйцеклеток, однакосерийные пересадкиядери культивированиеклеток«in vitro»вкакой-то степениувеличиваютэту способность.
Неудачиэкспериментов смышами
Успешныеопыты самфибиямизаставили задуматьсяучёныхо клонированиимлекопитающих, вчастностимышей.
Мак Киннелл воднойиз своихработахотмечал, что необходимыедляэтого методыужесуществуют инепонятнопочему мышьдосих порнеклонирована.
Однако предсказанияМакКиннелла не сбылись, хотявконце 70-х гг.опытына мышахдействительноначались ипротекаливесьма драматично. Ктомувремени весьмаосновательнобыли изученыбиологияи генетикараннихэтапов развитиямлекопитающихивчастности мышикакмодельного объекта.
Работаметодически оказаласьдовольно трудной, преждевсего, потомучтообъём яйцеклеткиумлекопитающих примерновтысячу разменьше, чему амфибий. Однакоэтитрудности былиуспешнопреодолены. Экспериментаторынаучились успешномикрохирургическимпутём удалять пронуклеусы(одноиз двухгаплоидныхядер вяйцемлекопитающих, впериод послепроникновениясперматозоида, но до слиянияженскогои мужскогопронуклеусовв ядрозиготыв процессеоплодотворения. Мужскоеядро формируетсяизядерного материаласперматозоида, женскоеизхромосом яйцеклетки)иззигот мышиипересаживать внихклеточные ядрараннихэмбрионов. Однаковсе полученныеразнымспособом зародышимышейразвивались лишьдостадии бластулы.
В1977 годупоявилосьсенсационное сообщениеХоппери Илменсеотом, что ониполучили7 взрослыхсамокмышей, пять изкоторыхимели толькоматеринский, адве отцовскийгеном. Это, якобы, зависелооттого, какойпронуклеусбыл оставленвяйце – женскийили мужской, ониопределял особипотипу гиногенезаилиандрогенеза (гиногенез – развитиеяйцабез участиясперматозоида, андрогенез – развитиеяйца, имеющиетолько отцовскиехромосомы – мужскойпартеногенез).
Их успехбылсвязан, по описаниюавторов, стем, что, удаляяодинпронуклеус, ониудваивали числохромосом другого, обрабатываяяйца специальнымвеществом, затемвыращивали полученныедиплоидныегомозиготные зародышиin vitroдостадии бластулыипересаживали вматкусамки-реципиентадля дальнейшегоразвития.
Казалось, теперьможно будетбыстрополучить млекопитающихсо100% гомозиготностьюпо всемпризнакам. Этоособенно важнодляселекции, так какдляполучения сельскохозяйственныхживотных, вчастностикрупного рогатогоскотас закреплённымиособоценными качествамиобычнымиприёмами требуютсядесяткилет работы.
Однакоданные ХоппериИльменси подтвердитьнеудалось, хотя многиепыталисьэто сделать. Оказалось, что полученныелюбымспособом диплоидныеандрогенетическиеи гиногенетическиезародышимышей погибают,атех жестадиях, чтои диплоидныепартеногенетические(развивающиесяизнеоплодотворённойяйцеклетки) эмбрионы.
Значительноусовершенствовавметоды извлеченияядери введенияихв клетку, Мак Грат иСолитер провелисвоюсерию экспериментовисообщили, что высокийвыходживых мышейониполучили, когдав качестведоноровядер онииспользовализиготы, но еслидонорамибыли ранниеэмбрионы, тореконструированныеяйцеклетки, каки прежде, развивалисьтолькодо стадиибластулы.
Метод Мак Грата- Солитерасталшироко использоватьсяразнымиэкспериментаторами. ТакМанн иЛовел-Банжвыделяли пронуклеусыяиц, активированных к партеногенезу, и пересаживал ихвэнуклеированныезиготы мышей. В этихслучаяхэмбрионы погибалинаранних стадиях.
Если же, наоборот, пронуклеусы получалиизоплодотворённыхяиц ипересаживалив партеногенетическиеилишённые ядраяйца, то такие зародыширазвивалисьнормально дорождения.
Сурамиссоавторами установили, чтоеслидобавить женскиепронуклеус из зиготымышик гаплоидномунаборухромосом яйцеклетки, тонормальногоразвития непроисходит, добавлениеже мужскогоядраприводит кнормальномуразвитию. С другойстороны, рекомбинацияженского имужскогопронуклеусов израннихоплодотворённыхяйцеклеток мышейобеспечиваетнормальное развитие, акомбинация2-х мужскихили2-х женскихпронуклеусовостанавливает развитиеэмбриона.
Этиопыты показали, чтодлянормального развитиямлекопитающихтребуется дванаборахромосом – отцовскийи материнский. Поэтомуниу одногоизизвестного видамлекопитающихне описанпартеногенез. Поэтомуже работыХоппериИльменсене удалосьповторить.
Однако такие исследование ещё дважды будоражили научноесообщество. В1982 годупересадилиядра клетокпартеногенетическихбластул мышей в энуклеированные зиготы. Некоторые из этихреконструированных яйцеклеток нормально развивались, иякобыполучены четыре взрослых самки, нов свете вышесказанного этирезультатымаловероятны.
Гибель партеногенетических (гиногенетических и андрогенетических)зародышейу млекопитающихсвязанас различнойактивациейонтогенеза материнскогоиотцовских геномов. Механизм, регулирующий этифункциональныеразличия, был названгеномнымимпритингом иизучалсяв рядеработ, гдебыло показано, чтодлянормального развитиямлекопитающихтребуется наличиемужскогогенома.
ДругаястатьяИльменсе иХопперимела ещёбольшийрезонанс. Авторысообщили опересадкиядер внутреннейклеточноймассы бластулывэнуклеированныезиготы мышейиполучения трёхвзрослыхособей (двухсамоки одногосамца), генетическиидентичной донорскойлиниимышей.
Введениеядер-донорови удалениепронуклеусовиз зиготыпроводилиза одинприём, затемреконструированныеяйцеклетки культивировали«in vitro» достадии бластулы ипересаживалив маткусамок. Из16 пересаженныхбластултри развилисьвовзрослые особи. Вследующейработе этижеавторы использоваливкачестве доноров-ядерклеткиэмбрионов ещёболеепоздней стадии (семьсуток)и будтобыполучили трёхполовозрелыхмышей. Однако никтоизработающих втомже направлениинесмог добитьсяподобныхрезультатов, идостоверность результатовИльменсеиХоппервновь былапоставленапод сомнение.
Мак ГратиСолитерпоказали, что ядра8-клеточныхзародышей иклетоквнутренней клеточноймассыбластулы необеспечиваютразвития «invitro» реконструированных яйцеклетокдажедо стадииморулы, котораяпредшествует стадиибластулы. Наибольшаячасть (5%) 4-клеточныхзародышейдаёт возможностьразвиватьсятолько достадииморулы. В тожевремя19% реконструированных яйцеклеток2-ядерныхклеточных зародышей, смоглиспокойнодостичь стадииморулыили бластулы.
Эти идругиеданные показывают, чтовэмбриогенезе умышейклеточное ядроранотеряет тотипотентность, чтосвязано, очевидно, соченьранней активизациейгеномазародыша – ужена стадияхдвухклеток. У другихмлекопитающих, вчастности укроликов, овеци крупногорогатогоскота, активизацияпервой группыгеновв эмбриогенезепроисходитпозднее, на 8-16клеточнойстадии.
Возможно,поэтому первыезначительныеуспехи вклонированииживотных былидостигнутына другихвидахмлекопитающих, ане на мышах.
Тем неменее,особый интересвызываютопыты группыучёныхиз университетавГонолулу воглавес РиузоЯнагимачи. Авторамудалось усовершенствоватьметодУилмута. Они отказалисьотэлектрической стимуляциислияниядонорской соматическойклеткис яйцеклеткойи изобрелитакую микропипетку, спомощьюкоторой можнобылобы безболезненноизвлекать ядроиз соматическойклеткиитрансплантироватьего вобезъядреннуюклетку. Кроме того, авторыиспользовалив качестведонорскихотносительно менеедифференцированныеядра клеток, окружающихооцит.Наконец, удалось,какбысинхронизироватьпроцессы, протекающиевяйцеклеткеи трансплантируемомв нёмядре, что позволилообеспечитьестественные ядерно-цитоплазматические взаимоотношениямежду ядромицитоплазмой, посколькутрансплантируемоедифференцированноев определённомнаправленииядро ицитоплазмаяйцеклетки дотогоработали какбыв разныхрежимах.
Авторы использовалидлятрансплантацииядра клеток, окружающихооцит, клетокСертолииз семенниковиклеток, выделенныхиз мозга. Ядра, выделенные из соматических клеток, инъецировали вэнуклеированноеяйцо спомощьюмикропипетки. Яйцоактивировали кразвитию, поместивв специальныйраствор , свободныйоткальция, и добавляястронцийи цитохалазин. Стронций активироваляйцо, акальций подавлялобразованиеполярных телец. Эмбрионов культивировалидостадии 2-8клеток, морулыили бластулы, азатем трансплантироваливматку приёмной матери, гдемногие из них имплантировалисьинекоторые из них(15-16%) продолжалисвоёразвитие.
Процентвыходарождённых мышат (их извлекали с помощью кесаревасечения на 18, 19-й дни беременности) был, однако, низок – вразныхсериях экспериментов от 2до2,8%. Молекулярныеисследования доказалипринадлежность ядеррождённых мышаткклеткам донорасоматическихклеток. Таким образом, по крайней мере в некоторых случаях доказана способность ядер соматических клеток обеспечивать нормальное развитиемлекопитающих. Но работыс мышами, значительно расширилинашипредставления ометодологиимлекопитающих.
Кроликии коровы
Американскиеисследователи СтекиРобел, используяметодСолитераиМак Грата, получилишестьживых кроликов, пересадивядра8-клеточных эмбрионоводнойпороды влишённыеядра яйцеклеткикроликовдругой породы. Фенотипродившихсяполностью соответствовалфенотипудонора.
Однакотолько 6из164 реконструированных яйцеклеток(3,7%)развились внормальныхживотных. Это, конечно, оченьнизкий выход, практическинепозволяющий рассчитыватьнаполучение такимспособомклона генетическиидентичныхживотных. Ценностьэтой работы, темнеменее, втом, чтоона показалавозможностьклонирования эмбрионовкроликов.
Работас реконструированными яйцеклеткамикрупныхдомашних животных, коровилиовец, идёт несколькопо-другому. Ихсначала культивируютне«in vitro», а «invivo» – в перевязанномяйцеводеовцы – промежуточного (первого) реципиента. Затемих оттудавымываюти трансплантируютвматку окончательного(второго)реципиента – коровыили овцысоответственно, гдеих развитиепроисходитдо развитогодетёныша. Уиландсинпредложилзаключить реконструированные яйцеклеткивагаровый цилиндр, которыйонпотом трансплантировалвперевязанный яйцеводовцыили коровы. Поданнымодних авторов реконструированные зародышилучшеразвиваются вяйцеводе, чемвкультивированнойсреде, хотя некоторыеисследователиполучили неплохиерезультатыи прикультивировании«in vitro».
АмериканцыРобел иегосотрудники использовалищадящийметод извлеченияядрабез прокалываниямембраныяйцеклетки, предложенныеМак Гратом иСолитером, пересаживалив зиготытакназываемые кариопласты – мужскойиженский пронуклеусывместес окружающейихцитоплазмой, атакже ядра2-, 4-или 8-клеточныхэмбрионовкоровы.
Сначалапронуклеусы центрифигурировали, чтобы освободитьпронуклеусыот окружающихихгранул желтка, послечегоядра былихорошовидны подмикроскопом, чтозначительно облегчалоихудаление. При помощиманипулятораи заострённойстекляннойпипетки извлекалиодиниз бластомероввместес ядромизранних зародышейипереносили еговэнуклеированнуюзиготы
Реконструированные зародыши были заключенывагаровый цилиндрипересажены в перевязанныйяйцевод овцы. Черезпятьдней культивированияихвымывали, освобождалиотагораи исследовали. Реконструированные зародышивэтом случаеразвивалисьтолько втехслучаях, где зиготывзиготы пересаживалипронуклеусы: 17%такихзародышей достиглистадииморулы илибластулы. Двазародыша былипересажены второму реципиенту – в матку коровы и развитие ихзавершилось рождением живых телят. Если в качестве доноров использовали ядра 2-, 4- и 8-клеточныхзародышей, тореконструированныеяйцеклетки неразвивалисьдаже достадииморулы.
Позжебыли иболееуспешные работы. Уиландсин, в частности,сообщил, чтоему удалосьполучитьчетырёх генетическиидентичныхбычков холстейскойпородыв результатепересадкив реципиентныеяйцеклеткиядер бластулодного32-клеточного зародыша. Авторутверждал, чтобольшинствоядер сохраняюттотипотентностьна 32-клеточнойстадии, азначительная ихчасть64-клеточной стадии, обеспечивая нормальноеразвитие реконструированныхяйцеклеток достадииморулы вяйцеводе.
После пересадкивматку коров – окончательных реципиентов. Какполагаетавтор, они могутидальше нормальноразвиваться.
Бондиолии соавторы, используявкачестве доноровядер 16-64-клеточныезародыши коров, трансплантировали463реконструированныхзародыша вматкусинхронизированныхреципиентов, ибыло получено 92живых телёнка.
Семь изнихбыли генетически идентичны, представляясобой клон, полученныйв результатепересадкиядер клетокодногодонорского эмбриона.
Такимобразом, клеточныеядразародышей крупногорогатогоскота достаточнодолгосохраняют тотипотентностьимогут обеспечитьполноеразвитие реконструированныхяйцеклеток. Иначеговоря, методическиетрудности клонированиязародышейкрупного рогатогоскотапрактически решены. Ноостаётсяосновная задача – найтидонорскиеядра, обладающиетотипотентностью, дляклонирования взрослыхживотных.
Клонированиеовец
Уиландсинещё в1986году показал, что эмбрионыовец на16-клетоной стадии развития сохраняют свою тотипотентность. Реконструированные яйцеклетки, содержащие ядра бластомеров16-клетоныхзародышей, развивалисьнормально достадиибластулы вперевязанномяйцеводе овцы (в агаровом цилиндре), а послеосвобожденияотагора,пересаживали вматкуовцы – второгореципиента – ещёна 60дней. Вдругом случаедонорамислужили ядра8-клетоныхзародышей ибылиполучены триживыхягнёнка, фенотипкоторых соответствовалпородеовцы-донора.
В1989году СмитиУилмут трансплантировалиядраклеток 16-клетосного эмбриона и ранней бластулы в лишённые ядранеоплодотвореннойяйцеклетки овец. Впервомслучае былополученодва живыхягнёнка, фенотипкоторых соответствовал породе овец – доноров ядер. Вовторомслучае одинполностьюсформировавшийсяягнёнок погибвовремя родов. Егофенотиптакже соответствовалпороде-донору. Авторы считали, чтовходе дифференцировкиэмбрионныхклеток происходитинактивациянекоторых важныхдляразвития геновив результатеядрабластулы уженемогут репрограммироватьсявцитоплазме яйцеклетки и обеспечить нормальное развитиереконструированногозародыша. Поэтому, помнению авторов, вкачестведоноров ядер лучше использовать 16-клеточные эмбрионы иликультивированныеin vitroлинииэмбриональных клеток, ядракоторыхобладают тотипотентностью.
Позднее, в 1993-95 гг., группа исследователей под руководствомУилмутаполучила клоновец – пять идентичных животных, донорамиядеркоторых была культура эмбриональных клеток. Клеточную культуруполучали следующим образом: выделяли микрохирургическим путёмэмбриональный диск из 9-дневного овечьего эмбриона (бластулы) икультивироваликлетки «invitro» втечениемногих пассажей (до25). Сначалаклеточная культуранапоминалакультуру стволовыхдифференцированных эмбриональных клеток, новскоре, после2-3 пассажей, клеткистановилисьуплотнёнными иморфологическисходными сэпителиальными. Эталиния клетокиз9-дневного зародышаовцыбыла обозначенакакTNT4.Чтобыдонорское ядроиреципиентная цитоплазманаходиласьна сходныхстадияхклеточного цикла, останавливалиделениекультивируемыхклеток TNT4наопределённой стадии(GO) иядраэтих клетокпересаживалив энуклеированныеяйцеклетки(соответственнона стадииметафазыII). Реконструированныеэмбрионы заключалив агор и трансплантироваливперевязанные яйцеводыовец. Черезшесть днейэмбрионывымывали изяйцеводовпромежуточных реципиентовиисследовали подмикроскопом. Отбиралите, которые достигалистадииморулы ибластулыи пересаживалиихв маткуовцы – окончательногореципиента, гдеразвитие продолжалосьдорождения. Родилосьпять ягнят (самок), изнихдве погибливскорепосле рождения, третьяввозрасте десяти дней, адвеоставшихся нормальноразвивалисьи достигли8-9-месячноговозраста. Фенотипическивсе ягнятабылисходны спородойовец, от которойполучалиисходную линиюклетокTNT4. Этоподтвердил игенетическийанализ.
Эта работа, особенновчасти культурыэмбриональныхклеток, - значительноедостижение вклонированиимлекопитающих, хотяона иневызвала особогоинтереса, какстатья тогожеУилмута ссоавторами, опубликованнаяв 1997 году, гдесообщалось, чтов результатеиспользованиядонорского ядраклеткимолочной железыовцыбыло полученоклональноеживотное – овцапо кличкеДолли.
Последняяработа методическивомногом повторялапредыдущиеисследования 1996года, нов нейучёныеиспользовали нетолькоэмбриональные, ноещё ифибробластоподобныеклетки (фибробласты – клетки соединительнойткани)плода иклеткимолочной железы взрослойовцы.
Клетки молочнойжелезыполучали от6-летнейовцы породы ФиннДорвет, находящейсяна последнемтриместребеременности. Всетри типаклеточныхкультур имелиодинаковоечисло хромосом – 54, какобычноу овец. Эмбриональныеклеткииспользовали вкачестведоноров ядерна7-9 пассажахкультивирования, фибробластоподобныеклеткиплода на4-6пассажах иклеткимолочной железына3-6 пассажах. Делениеклетоквсех трёхтиповоставливали настадииGO иядраклеток пересаживаливэнуклеированныеооциты (яйцеклетки) настадииметафазы II. Большинство реконструированныхэмбрионовсначала культивироваливперевязанном яйцеводеовцы, нонекоторые эмбрионыкультивировали in vitroв химическиопределённойсреде. Коэффициентвыхода морулибластул прикультивированииin vitroв однойсерииопытов былдажевдвое выше, чемприкультивированиив яйцеводе(поэтомувидимо нетстрогойнеобходимости впромежуточномреципиенте иможнообойтись культивированием « invitro»).
Выход морули бластулвсерии опытовскультурой клетокмолочнойжелезы, был примерновтроеменьше, чем вдвухдругих сериях, когдавкачестве доноровядериспользовали фибробластовплодаили эмбриональныхклеток. Числоживых ягнятвсравнении счисломпересаженных вматкуокончательногореципиента морулилибластул былотакжев дваразаниже. В серииопытовс клеткамимолочнойжелезы и277реконструированныхяйцеклеток былполучентолько одинживойягнёнок, что говоритобочень низкойрезультативноститакого родаэкспериментов (0,36%).
Анализгенетических маркероввсехсеми родившихсявтрёх серияхэкспериментовживых ягнятпоказал, чтоклетки молочнойжелезыбыли донорамиядердля одного, фибробласты плода – длядвух иэмбриональныеклетки четырёхягнят. ОвцаДолли развиласьизреконструированнойяйцеклетки, доноромядра которойбылакультивируемаяклетка молочнойжелезыовцы породыФиннДорвет.
Доллифенотипически неотличаетсяот овецэтойпороды, но сильноотличаетсяот овцы-реципиентапородышотландская черномордая. Анализгенетическихмаркеров подтвердилэтотрезультат.
Успех авторовэтойработы, преждевсего,связан сиспользованиемдлительных клеточныхкультур, таккак послемногихпассажей вкультуреклеток моглибытьотобраны малодифференцированные стволовыеклетки, которыевероятно ибылииспользованы какдонорыядер. Большое значениеимелтакже тотфакт, чтоавторы, учитываярезультатсвоих прошлыхработ, синхронизировалистадииклеточного циклаяйцеклеток реципиентаияйцеклеток донора.
Своей работойУилмутс коллегамипродемонстрировали, чтоядра клетокмолочнойжелезы взрослойовцымогут бытьприопределённых условияхрепрограммированыцитоплазмой ооцитаидать развитиеновомуорганизму. Полученныеданные заставилипо-новомупосмотреть напроцессклеточной дифференцировки. Этотпроцесс, какоказалось, неносит необратимыйхарактер. Совершенноясно, чтоцитоплазматическиефакторы способныинициироватьразвитие новогоорганизмана основегенетическогоматериала ядравзрослойполностью дифференцированнойклетки. Такимобразом, биологическиечасы могутбытьповёрнуты вспять, иразвитиеорганизма можетначатьсяиз генетическогоматериалавзрослой дифференцированнойклетки, чтополностьюпротиворечить раннееобщепринятойбиологической догме.
Если результатыпоследнейработы Уилмутаисоавторов окончательноподтвердятсяи будетповышенкоэффициент выходаживыхживотных прииспользованиив качестведоноровядер клетоквзрослыхживотных, то этоможетиметь революционноезначениекак вбиотехнологииживотных иживотноводстве. Клонированиепозволитсохранить нетолькогенотип ценныхивыдающихся впроизводственномотношении животных, ноибезгранично размножатьих.
5. Тканевоеклонирование
Учёные хотятсоздаватьчеловеческие эмбрионывлабораториях ииспользоватьихдляполучения специальныхклеток, которыемогут применятьсявреволюционных методикахлечения. Правдаклонирование неочень-топодходит дляназванияэтой операции, таккаквызывает непониманиеулюдей, что женасамом делепроисходит? Учёныене копируютэмбрионы, ониберут генетическийматериализ клеткителавзрослого человекаипересаживают еговяйцеклетку, изкоторой удалёнгенетическийматериал.
При соблюденииопределённыхусловий этановаяяйцеклетка можетразвиватьсяв эмбрион. Этатасамая технология, котораябылаиспользована длясозданияовечки Долли.
Почемуучёные такинтересуютсяэтой технологией? Этодаётвозможность получитьтакназываемые стволовыеклеткиразличных тканей, абсолютноидентичныхклеткам человека, укоторогобыл взятгенетическийматериал. Например, учёныемогут получитьнервнуюткань, кровь, сердечнуюмышцу идажебелое исероевещество мозга.
Учёныепытались выделитьстволовыеклетки определённыхтканейна протяжениимногихлет, когда, наконец, этоудалось в1998году. Учёные утверждают, чтостволовыеклетки могутобеспечитьмедиков полностьюсовместимойтрансплантационнойтканью. Первоначальнопланируется имплантироватьклеткив организмдлявосстановлениядефектов тканей, вызванныхболезнью, например, восстановлениесердечноймышцы послеинфаркта. Вбудущем планируетсядобитьсявозможности выращиватьизстволовых клетокполностьюработоспособныеткани.
Почемуклонирование являетсянеотъемлемойчастью этого?
Клонированиетак важно, потомучтопозволяет создатьткании органысполностью идентичнымгенетическимкодом. В настоящеевремяглавная проблематрансплантологии – отторжениепересаженныхорганов итканейиз-за иммунногоконфликта.
Медикииспользуют дляегорешения мощныеиммунодепрессивныепрепараты, которыеобладают большимколичествомпобочных эффектов. Клонирование полностьюрешаетэту проблему – клеткиимплантантыимеют тожегенотип и иммуннаясистема признаётихза своиродные. Этоснимает проблемупоискагенетически подходящихдоноров, например, припересадкикостного мозга. ИспользуяДНК, взятоеиз клетоккожи, учёныемогут создатьклеткикостного мозга.
При помощитканевогоклонирования можнолечитьлюбые болезни, вызывающие дегеративныеизменениятканей. Новая нервнаятканьможет помочьприболезни Альцгеймера, новаясердечнаяткань приинфаркте.
Правдапротив тканевогоклонированияесть многопротивников. Многиедумают, что эмбрион, дажееслиэто однаклетка, представляетсобой полноценнуючеловеческуюжизньиуничтожение егоилиопыты наднимравны действиямнадвзрослым человеком.
6. Задачи, стоящие перед клонированием
Клонирование органов и тканей - это задача номер один в области трансплантологии, травматологии и в других областях медицины и биологии. При пересадке клонированного органа не надо думать о подавлении реакции отторжения и возможных последствиях в виде рака, развившегося на фоне иммунодефицита. Клонированные органы станут спасением для людей, попавших в автомобильные аварии или какие-нибудь иные катастрофы, или для людей, которым нужна радикальная помощь из-за заболеваний пожилого возраста (изношенное сердце, больная печень и т.д.).
Самый наглядный эффект клонирования- дать возможность бездетным людям иметь своих собственных детей. Миллионы семейных пар во всем мире сегодня страдают, будучи обреченными, оставаться без потомков. По признанию Андрея Акопяна, директора Республиканского Центра репродукции человека Минздрава РФ, у нас в стране бесплодна каждая шестая-седьмая семейная пара. Какие трагедии, какие семейные драмы возникают на этой почве! И вот, оказывается, эту ситуацию можно изменить. Можно иметь своего собственного ребенка, реальное продолжение самого себя во времени.
Клонирование поможет людям, страдающим тяжелыми генетическими болезнями. Если гены, определяющие какую-либо подобную болезнь, содержатся в хромосомах отца, то в яйцеклетку матери пересаживается ядро ее собственной соматической клетки, - и тогда появится ребенок, лишенный опасных генов, точная копия матери. Если эти гены содержатся в хромосомах матери, то в ее яйцеклетку будет перемещено ядро соматической клетки отца, - появится здоровый ребенок, копия отца.
Более скромная, но не менее важная задача клонирования - регулирование пола сельскохозяйственных животных и клонирование в них сугубо человеческих генов, "терапевтических белков", которые используются для лечения людей. Например, гемофиликов, которые страдают от мутаций в гене, кодирующем кровеостанавливающий белок ("фактор IX"). Сегодня эти белки добывают из крови доноров, а те бывают разные, в том числе и инфицированные вирусом СПИДа. Вот почему гемофилии считаются "группой риска" по СПИДу. В последнем номере за 1997 год журнал "Сайенс" сообщил о клонировании американскими учеными шести овец, три из которых несли человеческий ген фактора IX. Героиней стала овечка Долли, у которой ген активно работает! Со временем, когда она подрастет и обзаведется своим потомством, в ее молоке будет и человеческий белок, отличающийся от овечьего. Так овечка Долли станет служить на благо человечеству.
Учитывая опыт шотландцев, американцы несколько модифицировали метод клонирования, использовав ядра эмбриональных, то есть зародышевых, фибробластов - клеток, дающих соединительную ткань, взятых из взрослого организма. Тем самым они резко увеличили эффективность метода, а также облегчили задачу введения "чужого" гена, поскольку в культуре фибробластов это делать значительно легче и дешевле.
Обошли они с помощью зародышевых клеток и тепломерный "запрет". Вполне возможно, что все эти разумные доводы повлияли на американских законодателей, которые приняли в конгрессе билль о клональных правах: клонирование человека запрещается всего лишь на десять лет, запрет не распространяется на животных и клонирование органов и тканей.
Многие клоны животных рождаются с генетическими изменениями и часто болеют раком. В ходе последних исследований было установлено, что причиной этих проблем может быть специфический ген, ответственный за контроль над развитием клеток. При обычном воспроизводстве копия этого гена передается от одного из родителей плоду. Однако у многих животных, в отличие от людей, один из этих генов исчезает. Процесс клонирования воздействует на оставшийся активный ген. В результате он не может выполнять свои функции, и клонированный эмбрион развивается без соответствующего контроля. К примеру, у овец менее одного эмбриона из 300 развивается нормально. Даже всемирно известная овечка Долли страдает от проблем, связанных с этим геном – она быстро стареет и набирает вес.
Таким образом, клонирование человека является сложным и непредсказуемым процессом, последствия которого лягут тяжелым бременем на все общество, если эксперименты с клонированием человека завершатся успешно. Клон человека может стать лишь генетической копией донора, он может унаследовать от него рост, цвет волос, цвет глаз и другие физические характеристики, однако это будет совершенно другой человек, с другим характером и прочими психологическими характеристиками. Такие же различия мы можем наблюдать между однояйцовыми близнецами, которые, несмотря на схожий генетический материал, являются разными и во многом
непохожими людьми.
Заключение
Итак, работыпо клонированиюпозвоночныхбыли начатынаамфибиях вконце40-х начале50-хгг. ипродолжаютсявот ужеболее4-х десятилетий. Что касается амфибий, то,какбыло сказановсоответствующемразделе, несмотряна значительныедостижения, проблемаклонированиявзрослых особейостаётсядо сихпорнерешённой.
Установлено, чтов ходеклеточнойдифференцировкиу позвоночныхпроисходитлибо потеряопределённыхгенных локусовлибоих необратимаяинактивация. Судяпо всему, утрачиваетсятачасть генома, котораяконтролируетне ранние, аболеепоздние стадиионтогенеза, вчастности метаморфозамфибий. Механизмэтого явлениянеподдаётся поканаучномуобъяснению. Ноочевидно, что дляклонированиявзрослых животныхнеобходимоиспользовать малодифференцируемые делящиеся клетки.
Ещё 5-6летназад никтоихучёных неставилвопрос обиспользованиив качестведоноровядер клетоквзрослыхмлекопитающих. Работысводились восновномк клонированиюэмбрионовдомашних животных, имногихиз этихисследованийбыли неоченьуспешны. Поэтомутак поразилопоявившиесяна светвначале 1997годасообщение Уилмута, чтоемуи егоколлективуудалось, используясоматическиеклетки взрослыхживотных, получитклональное животноеовцупо имениДолли.
Каковоже положениевещейсейчас? Есть лисерьёзныеоснования считать, чтореальнонаступила эраклонированиямлекопитающих? Анализпредставленныхвыше данныхпоказывает, чтоза последниедесятьлет врезультатекропотливой работымногихисследователей, действительносделан прорыввобласти клонированияэмбрионовмлекопитающих.
Что жекасаетсявзрослых животных, топокав наличиилишьодин пример, хотяДолли, безсомнения, уже вошлависторию науки.
Ноуэтого первогоуспешногоэксперимента естьсущественныйнедостаток – оченьнизкий коэффициентвыходаживых особей(0,36%)и еслиучестьвысокий процентгибелиразвивающихся реконструированных яйцеклетоквплодный периодразвития(62%), который в десятьраз выше, чемв обычномскрещивании(6%), то встаётвопросо причинахгибелизародышей.
Вближайшие годыглавнаязадача исследователей, работающихвобласти исследованияклонирования – это, по-видимому, создание культивируемыхin vitroлиниймалодифференцированныхклеток, характеризующихсявысокой скоростьюделения. Ядраименно такихклетокдолжны обеспечитьполноеи нормальноеразвитиереконструированныхяйцеклеток, формированиене толькоморфологическихпризнаков, но инормальныхфункциональныххарактеристик клонированногоорганизма.
Чтоже касаетсявопросао клонированиичеловека, тов обсужденииэтоговопроса следуетвыделитьдва аспекта: методическийи этический.
Методически или техническиклонированиевзрослых млекопитающихразработаноещё недостаточно, чтобыможнобыло ужесейчасставить вопросоклонировании человека. Дляэтогонеобходимо расширитькругисследований, включивв негокромеовец представителейидругих видовживотных. Уилмутс сотрудникамипланируют, например, продолжитьсвоиработы накоровахи свиньях. Такиеработынеобходимы, чтобыустановить, неограничиваетсяли возможностьклонированиявзрослых млекопитающихособенностямиили спецификойкакого-либоодного илинесколькихвидов.
Затемнеобходимо существенноповыситьвыход жизнеспособных реконструированныхэмбрионови взрослыхклонированныхживотных, выяснивне влияютлиметодические приёмынапродолжительностьжизни , функциональныехарактеристикии плодовитостьживотных. Дляклонирования животныхоченьважно снизитьрискдефективного развитияреконструированнойяйцеклетки, главнойпричиной которогоможетбыть неполноерепрограммированиегенома донорскогоядра.
Кстати, в природевсё-такиимеются случаиклонированиячеловека, это однояйцовыеилимонозиготные близнецы – настоящиеклоныс однимитем жегеномом, возникающиепри разделенииоднойзиготы нараннейстадии развития. Этовсегдатолько обамальчикаили обедевочкии всегдаудивительнопохожие другнадруга. Известнотакже, что эмбрионмлекопитающего, втом числеичеловека насамыхранних стадияхразвития, учеловека покрайнеймере достадии8 бластомеров, можетбытьбез видимыхотрицательныхпоследствий разделённаотдельные бластомеры, изкоторыхпри определённыхусловияхмогут развитьсяидентичныепо своемугенотипуособи, по аналогиисоднояйцовыми близнецами, тоестьиз одного8-клеточногоэмбриона могутродиться8 мальчиковилидевочек абсолютноидентичных.
Что касаетсяэтическойстороны, то тутклонированиечеловека вызываетещёбольше возражений. Во-первых, становление человекакакличности базируетсянетолько набиологическойнаследственности, оноопределяется такжесемейной, социальнойикультурнойсредой. При клонированиииндивиданевозможно воссоздатьвсете условиявоспитанияи обучения, которые сформировалиличностьего прототипа. Во-вторых, при бесполомразмноженииизначально жёсткаязапрограммированность генома предопределяетменьшееразнообразие взаимодействияорганизмас окружающимиизменчивымиусловиями среды. В-третьих, практически всерелигиозныеучения настаиваютнапоявлении человеканасвет – в “руках”высшихсил, что зачатиеирождение должныпроисходитьестественным путём.
В итогеговоритьо клонированиичеловека мыможемговорить лишьссугубо теоретическойточкизрения. В сущностиречьидёт даженео клонировании, аополучении копииотдельногоиндивида, посколькутермин клонированиепредполагаетполучение некоегомножестваособей. Очевидно, чтосегодня вероятностьотрицательныхпоследствий этойпроцедурызначительно превышаетеёвыгоды, поэтомуработы поклонированиючеловека, каквнастоящее время, такивближайшембудущем проводитьнецелесообразно, таккак переноситьещёнерешённую методическинаучнуюработу наопытыс человекомбезнравственно. ПоэтомуФедерация научныхэкспериментальныхобществ биологовСШАв октябре1997года объявилапятилетниймораторий наэкспериментыпо клонированиючеловека.
Когдажеусовершенствуетсяметодклонирования,и мысможемклонировать человека, топроблемаклонирования должнабудет регламентироватьсястрогими рамкамииправилами, касаясьвозможно толькомедицинскихпроблем, скажемнепреодолимогобесплодия.
Список литературы
1.Н. Грин, У. Стаут, Д. Тейлор, Биология, Москва, «Мир», 1993 г.
2.Ф. Киберштерн, Гены и генетика, Москва, «Параграф», 1995 г.
3.Т.А Шустанова, репетитер-самоучитель по биологии, Ростов н/Д,2006г.
4.Г.ИЛернер,Словарь-справочник для школьников, абитуриентов и учителей;Москва,2006г.
Хронология клонирования
1883 год - открытие яйцеклетки немецким цитологом Оскаром Гертвигом (Хертвигом, 1849-1922).
1943 год - журнал "Сайенс" сообщил об успешном оплодотворении яйцеклетки "в пробирке".
1953 год - Р.Бригс и Т.Кинг сообщили об успешной разработке метода "нуклеотрансфера" - переноса ядра клетки в гигантские икринки африканской шпорцевой лягушки "ксенопус".
1973 год - профессор Л.Шетлз из Колумбийского университета в Нью-Йорке заявил, что он готов произвести на свет первого "бэби из пробирки", после чего последовали категорические запреты Ватикана и пресвитерианской церкви США.
1977 год - закончилась публикация серии статей о работах профессора зоологии Оксфордского университета Дж.Гердона, в ходе которых было клонировано более полусотни лягушек. Из их икринок удалялись ядра, после чего в оставшийся "цитоплазматический мешок" пересаживалось ядро соматической клетки. Впервые в истории науки на место гаплоидного ядра яйцеклетки с одинарным набором хромосом было внесено диплоидное ядро соматической клетки с двойным числом носителей генетической информации.
1978 год - рождение в Англии Луизы Браун, первого ребенка "из пробирки".
1981 год - Шетлз получает три клонированных эмбриона (зародыша) человека, но приостанавливает их развитие.
1982 год - Карл Ильмензее из Женевского университета и его коллега Питер Хоппе из лаборатории Джексона в Бар-Харборе, штат Мэн, в которой с 1925 года разводят мышей, получили серых мышат, перенеся ядра клеток серого зародыша в цитоплазму яйцеклетки, полученной от черной самки, после чего эмбрионы были перенесены в белых самок, которые и выносили потомство. Результаты не были воспроизведены в других лабораториях, что привело к обвинению Ильмензее в фальсификации.
1985 год - 4 января в одной из клиник северного Лондона родилась девочка у миссис Коттон - первой в мире суррогатной матери, не являющейся матерью биологической (то есть "бэби Коттон", как назвали девочку, была зачата не из яйцеклетки миссисКоттон). Был вынесен парламентский запрет на эксперименты с человеческими эмбрионами старше четырнадцати дней.
1987 год - специалисты Университета имени Дж.Вашингтона, использовавшие специальный фермент, сумели разделить клетки человеческого зародыша и клонировать их до стадии тридцати двух клеток (пластов, бластомеров), после чего зародыши были уничтожены. Тогдашняя американская администрация пригрозила лишать лаборатории дотаций из федеральных фондов, если в них будут проводиться подобные опыты.
1996 год - 7 марта журнал "Нейчур" помещает первую статью коллектива авторов из института Раслин в Эдинбурге, которые сообщили о рождении пяти ягнят, полученных без участия барана: в цитоплазматические мешки яйцеклеток были перенесены ядра культуры эмбриональных клеток, полученных от другого зародыша. Администрация Билла Клинтона еще раз подтверждает свое намерение лишать поддержки федеральных фондов всех, кто вознамерится экспериментировать с человеческими эмбрионами; так, был лишен субсидий исследователь из Университета Вашингтона, осуществлявший анализ пола зародыша и анализ дефектных генов на стадии восьми клеток.
1997 год - 27 февраля "Нейчур" поместил на своей обложке - на фоне микрофотографии яйцеклетки - знаменитую овечку Долли, родившуюся в том же институте Раслин в Эдинбурге. В конце июня Клинтон направил в конгресс законопроект, запрещающий "создавать человеческое существо путем клонирования и ядерного переноса соматических клеток".
1997 год - в самом конце декабря журнал "Сайенс" сообщил о рождении шести овец, полученных по раслинскому методу. Три из них, в том числе и овечка Полли, несли человеческий ген "фактора IX" ("фактора 9"), или кровеостанавливающего белка, который необходим людям, страдающим гемофилией, то есть несвертываемостью крови.
1997 год - в США издается книга Майкла Смита "Клоны", в которой рассказывается о клонировании людей в подземных тоннелях вокруг Лос-Анджелеса (см. "Знание-сила", 1998, N4, стр. ).
1998 год - чикагский физик Сиди объявляет о создании лаборатории по клонированию людей: он утверждает, что отбоя от клиентов у него не будет.
1998 год, начало февраля - в Москве состоялась премьера американского фильма "Пришельцы. Воскрешение", по ходу которого в XXII веке военные исследователи клонируют земную женщину, чтобы изъять из нее (ее грудной клетки) развивающееся в ней маленькое неземное существо.
1998 год, начало марта - французские ученые объявили о рождении клонированной тёлочки.
По данным National Academic Press, по состоянию на начало 2002 г., в мире было клонировано 3156 эмбрионов овцы – живыми на свет появились лишь 50 клонированных животных. Из 8600 попыток клонировать корову успехом увенчались 111, из 7613 попыток клонирования мышей – 54. 78 раз ученые пытались получить клон обезьяны, однако успеха они достигли лишь в двух случаях.
2003 год -
было объявлено об успешном клонировании крысы.
Определения
Клон – совокупностьклетокили организмов, генетическиидентичныходной родоначальнойклетке.
Клонирование – получение идентичныхпотомковпри помощибеспологоразмножения, процессизготовления генетическиидентичныхкопий отдельнойклеткии организма.
Тотипотентность – свойство клеткиреализовыватьгенетическую информациюядра, обеспечивающегоразвитиедо целостногоорганизма. Тотипотентнаяклеткаспособна дифференцироватьсявлюбую тканьилиспециализированнуюклетку.
Партеногенез – развитие зародышаизнеоплодотворённойклетки, девственноеразмножение.
Гиногенез – развитиеяйцабез участиясперматозоида – женскийпартеногенез.
Андрогенез – развитиеяйца, имеющеготолько отцовскиехромосомы – мужскойпартеногенез.
Энуклеация – методы, включающие полноеудалениеядерного материалаизяйцеклетки.
Бластомеры – клетки, образующиеся придроблениияйца животных.
Морула – стадиявразвитии зародыша, наэтойстадии зародышнапоминаетпо внешнемувидумалину, без особойобособленнойполости.
Бластула – стадиявразвитии зародыша, представляющая собойполныйшар изодногослоя клеток, этастадиязавершает процессдробленияяйца. На стадиибластулывнутри зародышаобразуетсяполость – бластоцель.
Гаструла – стадиявразвитии зародыша, наэтойстадии зародышхарактеризуетсяналичием двухслойнойстенкии полости (гастроцеля), сообщающейся свнешнейсредой отверстием – бластопором.

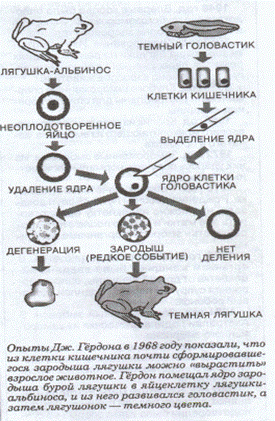

Рис.1 Схема клонирования лягушки. Лягушка-альбинос.


|
Рис.2.Клонированная овца Доллив 1996 году. |




Первый человеческий зародыш, полученный при помощи клонирования.